Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Interplay between iron species transformation and hydroxyl radicals production in soils and sediments during anoxic-oxic cycles
Geoderma ( IF 5.6 ) Pub Date : 2020-07-01 , DOI: 10.1016/j.geoderma.2020.114351 Yanting Zhang , Man Tong , Songhu Yuan , Ao Qian , Hui Liu
Geoderma ( IF 5.6 ) Pub Date : 2020-07-01 , DOI: 10.1016/j.geoderma.2020.114351 Yanting Zhang , Man Tong , Songhu Yuan , Ao Qian , Hui Liu
|
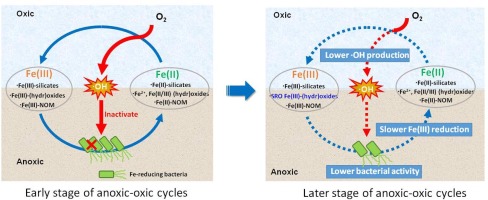
Abstract Iron (Fe) redox transformation in soils and sediments plays an essential role in the biogeochemical cycling of associated nutrients and elements. It is documented recently that hydroxyl radicals ( OH) can be produced upon oxygenation of Fe(II)-bearing minerals in soils and sediments. As OH induces serious oxidative stress to microbes, it is likely that OH produced upon Fe(II) oxygenation inactivates the coexisting dissimilatory iron-reducing bacteria and subsequently impacts Fe redox transformation. This hidden interplay between Fe species transformation and OH production in soils and sediments during anoxic-oxic cycles remains unexplored. In this study, a field sediment was incubated with 1 × 109 CFU/mL Shewanella oneidensis strain MR-1 and treated for six anoxic-oxic cycles (117-h anoxic and 6-h oxic periods). Fe species transformation, OH production and MR-1 activity variation were measured throughout the six cycles. Fe in the sediments prior to anoxic-oxic cycles mainly existed in Fe-bearing silicates (60–70%) and Fe (hydr)oxides (30–40%). For the anoxic periods, a portion of Fe(III) in sediments was either reduced to structural Fe(II) in (hydr)oxides and silicates or reductively dissolved to aqueous Fe2+. Total Fe(II) produced from Fe(III) bio-reduction increased from 2.46 to 8.24 mM in the first two anoxic periods, but decreased to 0.10 mM in the following four anoxic periods. For the oxic periods, Fe(II) was oxidized along with a production of OH, and the cumulative OH concentrations were around 31 µM in the first three periods but decreased to 6.3 µM in the subsequent three periods. MR-1 was inactivated by about 0.6 order of magnitude in the first two oxic periods, and the inactivation became insignificant for the later oxic periods. The six cycles of anoxic-oxic treatments promoted the transformation of Fe(III) (hydr)oxides into more amorphous phase. A strong interplay between Fe species transformation and OH production occurred in anoxic-oxic cycles. Fe(III) bio-reduction by MR-1 in anoxic periods determined the content and speciation of Fe(II), which governed OH production in the subsequent oxic periods. The generated OH affected MR-1 activity in oxic periods, which further controlled Fe(III) bio-reduction in anoxic periods. The hidden interplay identified herein improves our understanding of the cycling of Fe and associated elements under redox fluctuating environments.
中文翻译:

缺氧-好氧循环过程中土壤和沉积物中铁物种转化与羟基自由基产生之间的相互作用
摘要 土壤和沉积物中的铁 (Fe) 氧化还原转化在相关养分和元素的生物地球化学循环中起着至关重要的作用。最近有文献记载,土壤和沉积物中含 Fe(II) 的矿物质氧化时可以产生羟基 (OH)。由于 OH 会对微生物产生严重的氧化应激,因此 Fe(II) 氧化产生的 OH 可能会使共存的异化铁还原细菌失活,并随后影响 Fe 氧化还原转化。在缺氧-好氧循环过程中,土壤和沉积物中 Fe 物种转化与 OH 产生之间的这种隐藏的相互作用仍未得到探索。在本研究中,田间沉积物与 1 × 109 CFU/mL Shewanella oneidensis 菌株 MR-1 一起孵育,并进行六个缺氧-好氧循环(117 小时缺氧和 6 小时有氧期)。Fe 物种转化,在整个六个循环中测量 OH 产生和 MR-1 活性变化。缺氧-好氧循环之前沉积物中的铁主要存在于含铁硅酸盐(60-70%)和铁(氢)氧化物(30-40%)中。在缺氧时期,沉积物中的一部分 Fe(III) 要么被还原为(氢)氧化物和硅酸盐中的结构性 Fe(II),要么被还原溶解到 Fe2+ 水溶液中。Fe(III) 生物还原产生的总 Fe(II) 在前两个缺氧期从 2.46 增加到 8.24 mM,但在接下来的四个缺氧期减少到 0.10 mM。在好氧阶段,Fe(II)随着 OH 的产生而被氧化,前三个阶段的累积 OH 浓度约为 31 µM,但在随后的三个阶段下降到 6.3 µM。MR-1 在前两个好氧期被灭活了大约 0.6 个数量级,在后期的好氧期,失活变得微不足道。六个循环的缺氧-好氧处理促进了 Fe(III)(氢)氧化物转化为更多的非晶相。在缺氧-好氧循环中,Fe 物种转化和 OH 产生之间存在强烈的相互作用。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。六个循环的缺氧-好氧处理促进了 Fe(III)(氢)氧化物转化为更多的非晶相。在缺氧-好氧循环中,Fe 物种转化和 OH 产生之间存在强烈的相互作用。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。六个循环的缺氧-好氧处理促进了 Fe(III)(氢)氧化物转化为更多的非晶相。在缺氧-好氧循环中,Fe 物种转化和 OH 产生之间存在强烈的相互作用。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。
更新日期:2020-07-01
中文翻译:

缺氧-好氧循环过程中土壤和沉积物中铁物种转化与羟基自由基产生之间的相互作用
摘要 土壤和沉积物中的铁 (Fe) 氧化还原转化在相关养分和元素的生物地球化学循环中起着至关重要的作用。最近有文献记载,土壤和沉积物中含 Fe(II) 的矿物质氧化时可以产生羟基 (OH)。由于 OH 会对微生物产生严重的氧化应激,因此 Fe(II) 氧化产生的 OH 可能会使共存的异化铁还原细菌失活,并随后影响 Fe 氧化还原转化。在缺氧-好氧循环过程中,土壤和沉积物中 Fe 物种转化与 OH 产生之间的这种隐藏的相互作用仍未得到探索。在本研究中,田间沉积物与 1 × 109 CFU/mL Shewanella oneidensis 菌株 MR-1 一起孵育,并进行六个缺氧-好氧循环(117 小时缺氧和 6 小时有氧期)。Fe 物种转化,在整个六个循环中测量 OH 产生和 MR-1 活性变化。缺氧-好氧循环之前沉积物中的铁主要存在于含铁硅酸盐(60-70%)和铁(氢)氧化物(30-40%)中。在缺氧时期,沉积物中的一部分 Fe(III) 要么被还原为(氢)氧化物和硅酸盐中的结构性 Fe(II),要么被还原溶解到 Fe2+ 水溶液中。Fe(III) 生物还原产生的总 Fe(II) 在前两个缺氧期从 2.46 增加到 8.24 mM,但在接下来的四个缺氧期减少到 0.10 mM。在好氧阶段,Fe(II)随着 OH 的产生而被氧化,前三个阶段的累积 OH 浓度约为 31 µM,但在随后的三个阶段下降到 6.3 µM。MR-1 在前两个好氧期被灭活了大约 0.6 个数量级,在后期的好氧期,失活变得微不足道。六个循环的缺氧-好氧处理促进了 Fe(III)(氢)氧化物转化为更多的非晶相。在缺氧-好氧循环中,Fe 物种转化和 OH 产生之间存在强烈的相互作用。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。六个循环的缺氧-好氧处理促进了 Fe(III)(氢)氧化物转化为更多的非晶相。在缺氧-好氧循环中,Fe 物种转化和 OH 产生之间存在强烈的相互作用。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。六个循环的缺氧-好氧处理促进了 Fe(III)(氢)氧化物转化为更多的非晶相。在缺氧-好氧循环中,Fe 物种转化和 OH 产生之间存在强烈的相互作用。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。缺氧期间 MR-1 对 Fe(III) 的生物还原决定了 Fe(II) 的含量和形态,后者决定了随后的好氧时期 OH 的产生。产生的 OH 影响好氧期的 MR-1 活性,这进一步控制了缺氧期的 Fe(III) 生物还原。此处确定的隐藏相互作用提高了我们对氧化还原波动环境下 Fe 和相关元素循环的理解。











































 京公网安备 11010802027423号
京公网安备 11010802027423号