当前位置:
X-MOL 学术
›
J. Mol. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Dissecting the Functional Contributions of the Intrinsically Disordered C-terminal Tail of Bacillus subtilis FtsZ.
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2020-03-18 , DOI: 10.1016/j.jmb.2020.03.008 Megan C Cohan 1 , Anna M P Eddelbuettel 1 , Petra A Levin 2 , Rohit V Pappu 1
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2020-03-18 , DOI: 10.1016/j.jmb.2020.03.008 Megan C Cohan 1 , Anna M P Eddelbuettel 1 , Petra A Levin 2 , Rohit V Pappu 1
Affiliation
|
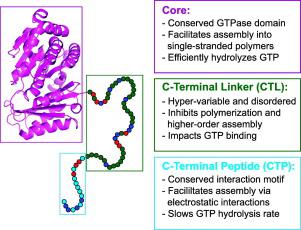
FtsZ is a bacterial GTPase that is central to the spatial and temporal control of cell division. It is a filament-forming enzyme that encompasses a well-folded core domain and a disordered C-terminal tail (CTT). The CTT is essential for ensuring proper assembly of the cytokinetic ring, and its deletion leads to mis-localization of FtsZ, aberrant assembly, and cell death. In this work, we dissect the contributions of modules within the disordered CTT to assembly and enzymatic activity of Bacillus subtilis FtsZ (Bs-FtsZ). The CTT features a hypervariable C-terminal linker (CTL) and a conserved C-terminal peptide (CTP). Our in vitro studies show that the CTL weakens the driving forces for forming single-stranded active polymers and suppresses lateral associations of these polymers, whereas the CTP promotes the formation of alternative assemblies. Accordingly, in full-length Bs-FtsZ, the CTL acts as a spacer that spatially separates the CTP sticker from the core, thus ensuring filament formation through core-driven polymerization and lateral associations through CTP-mediated interactions. We also find that the CTL weakens GTP binding while enhancing the catalytic rate, whereas the CTP has opposite effects. The joint contributions of the CTL and CTP make Bs-FtsZ, an enzyme that is only half as efficient as a truncated version that lacks the CTT. Overall, our data suggest that the CTT acts as an auto-regulator of Bs-FtsZ assembly and as an auto-inhibitor of enzymatic activity. Based on our results, we propose hypotheses regarding the hypervariability of CTLs and compare FtsZs to other bacterial proteins with tethered IDRs.
中文翻译:

剖析枯草芽孢杆菌 FtsZ 内在无序 C 末端尾部的功能贡献。
FtsZ 是一种细菌 GTP 酶,对细胞分裂的空间和时间控制至关重要。它是一种细丝形成酶,包含一个折叠良好的核心结构域和一个无序的 C 末端尾 (CTT)。CTT 对于确保细胞因子环的正确组装至关重要,它的缺失会导致 FtsZ 的错误定位、异常组装和细胞死亡。在这项工作中,我们剖析了无序 CTT 中的模块对枯草芽孢杆菌 FtsZ (Bs-FtsZ) 的组装和酶活性的贡献。CTT 具有一个高变 C 端接头 (CTL) 和一个保守的 C 端肽 (CTP)。我们的体外研究表明,CTL 削弱了形成单链活性聚合物的驱动力并抑制了这些聚合物的横向结合,而 CTP 促进了替代组装的形成。因此,在全长 Bs-FtsZ 中,CTL 充当将 CTP 贴纸与核心空间分离的间隔物,从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向缔合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 充当间隔物,在空间上将 CTP 贴纸与核心分开,从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向缔合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 充当间隔物,在空间上将 CTP 贴纸与核心分开,从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向缔合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向结合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向结合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。
更新日期:2020-03-18
中文翻译:

剖析枯草芽孢杆菌 FtsZ 内在无序 C 末端尾部的功能贡献。
FtsZ 是一种细菌 GTP 酶,对细胞分裂的空间和时间控制至关重要。它是一种细丝形成酶,包含一个折叠良好的核心结构域和一个无序的 C 末端尾 (CTT)。CTT 对于确保细胞因子环的正确组装至关重要,它的缺失会导致 FtsZ 的错误定位、异常组装和细胞死亡。在这项工作中,我们剖析了无序 CTT 中的模块对枯草芽孢杆菌 FtsZ (Bs-FtsZ) 的组装和酶活性的贡献。CTT 具有一个高变 C 端接头 (CTL) 和一个保守的 C 端肽 (CTP)。我们的体外研究表明,CTL 削弱了形成单链活性聚合物的驱动力并抑制了这些聚合物的横向结合,而 CTP 促进了替代组装的形成。因此,在全长 Bs-FtsZ 中,CTL 充当将 CTP 贴纸与核心空间分离的间隔物,从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向缔合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 充当间隔物,在空间上将 CTP 贴纸与核心分开,从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向缔合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 充当间隔物,在空间上将 CTP 贴纸与核心分开,从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向缔合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向结合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。从而确保通过核心驱动的聚合形成细丝,并通过 CTP 介导的相互作用确保横向结合。我们还发现 CTL 在提高催化速率的同时削弱了 GTP 结合,而 CTP 具有相反的作用。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。CTL 和 CTP 的共同贡献使 Bs-FtsZ 成为一种酶,其效率仅为缺乏 CTT 的截短版本的一半。总体而言,我们的数据表明 CTT 作为 Bs-FtsZ 组装的自动调节剂和酶活性的自动抑制剂。根据我们的结果,我们提出了关于 CTL 的高变性的假设,并将 FtsZ 与其他具有束缚 IDR 的细菌蛋白进行比较。











































 京公网安备 11010802027423号
京公网安备 11010802027423号