当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural Features of an Extended C-Terminal Tail Modulate the Function of the Chemokine CCL21.
Biochemistry ( IF 2.9 ) Pub Date : 2020-03-26 , DOI: 10.1021/acs.biochem.0c00047 Natasha A Moussouras 1 , Gertrud M Hjortø 2 , Francis C Peterson 3 , Martyna Szpakowska 4 , Andy Chevigné 4 , Mette M Rosenkilde 2 , Brian F Volkman 3 , Michael B Dwinell 1
Biochemistry ( IF 2.9 ) Pub Date : 2020-03-26 , DOI: 10.1021/acs.biochem.0c00047 Natasha A Moussouras 1 , Gertrud M Hjortø 2 , Francis C Peterson 3 , Martyna Szpakowska 4 , Andy Chevigné 4 , Mette M Rosenkilde 2 , Brian F Volkman 3 , Michael B Dwinell 1
Affiliation
|
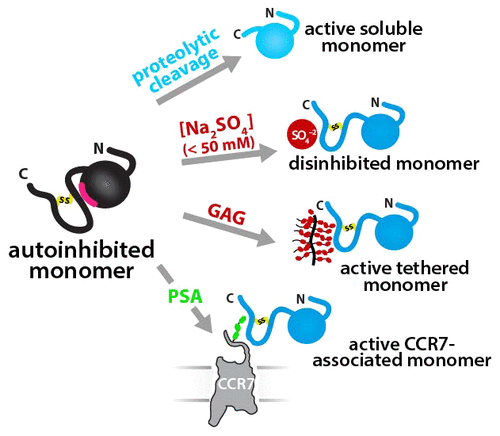
The chemokines CCL21 and CCL19, through binding of their cognate receptor CCR7, orchestrate lymph node homing of dendritic cells and naïve T cells. CCL21 differs from CCL19 via an unstructured 32 residue C-terminal domain. Previously described roles for the CCL21 C-terminus include GAG-binding, spatial localization to lymphatic vessels, and autoinhibitory modulation of CCR7-mediated chemotaxis. While truncation of the C-terminal tail induced chemical shift changes in the folded chemokine domain, the structural basis for its influence on CCL21 function remains largely unexplored. CCL21 concentration-dependent NMR chemical shifts revealed weak, nonphysiological self-association that mimics the truncation of the C-terminal tail. We generated a series of C-terminal truncation variants to dissect the C-terminus influence on CCL21 structure and receptor activation. Using NMR spectroscopy, we found that CCL21 residues 80–90 mediate contacts with the chemokine domain. In cell-based assays for CCR7 and ACKR4 activation, we also found that residues 92–100 reduced CCL21 potency in calcium flux, cAMP inhibition, and β-arrestin recruitment. Taken together, these structure–function studies support a model wherein intramolecular interactions with specific residues of the flexible C-terminus stabilize a less active monomer conformation of the CCL21. We speculate that the autoinhibitory intramolecular contacts between the C-terminal tail and chemokine body are disrupted by GAG binding and/or interactions with the CCR7 receptor to ensure optimal functionality.
中文翻译:

扩展的C末端尾巴的结构特征调节趋化因子CCL21的功能。
趋化因子CCL21和CCL19通过其同源受体CCR7的结合,协调树突状细胞和幼稚T细胞的淋巴结归巢。CCL21与CCL19的区别在于非结构化的32个残基C端结构域。先前描述的CCL21 C末端的作用包括GAG结合,对淋巴管的空间定位以及CCR7介导的趋化性的自抑制调节。虽然C末端尾巴的截断在折叠的趋化因子域中引起化学位移变化,但其对CCL21功能的影响的结构基础仍未开发。CCL21浓度依赖的NMR化学位移显示出微弱的,非生理学的自缔合,模仿了C末端尾巴的截短。我们生成了一系列的C末端截短变体,以剖析C末端对CCL21结构和受体激活的影响。使用NMR光谱,我们发现CCL21残基80-90介导与趋化因子域的接触。在基于细胞的CCR7和ACKR4活化分析中,我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。使用NMR光谱,我们发现CCL21残基80-90介导与趋化因子域的接触。在基于细胞的CCR7和ACKR4活化检测中,我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。使用NMR光谱,我们发现CCL21残基80-90介导与趋化因子域的接触。在基于细胞的CCR7和ACKR4活化检测中,我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。
更新日期:2020-03-27
中文翻译:

扩展的C末端尾巴的结构特征调节趋化因子CCL21的功能。
趋化因子CCL21和CCL19通过其同源受体CCR7的结合,协调树突状细胞和幼稚T细胞的淋巴结归巢。CCL21与CCL19的区别在于非结构化的32个残基C端结构域。先前描述的CCL21 C末端的作用包括GAG结合,对淋巴管的空间定位以及CCR7介导的趋化性的自抑制调节。虽然C末端尾巴的截断在折叠的趋化因子域中引起化学位移变化,但其对CCL21功能的影响的结构基础仍未开发。CCL21浓度依赖的NMR化学位移显示出微弱的,非生理学的自缔合,模仿了C末端尾巴的截短。我们生成了一系列的C末端截短变体,以剖析C末端对CCL21结构和受体激活的影响。使用NMR光谱,我们发现CCL21残基80-90介导与趋化因子域的接触。在基于细胞的CCR7和ACKR4活化分析中,我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。使用NMR光谱,我们发现CCL21残基80-90介导与趋化因子域的接触。在基于细胞的CCR7和ACKR4活化检测中,我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。使用NMR光谱,我们发现CCL21残基80-90介导与趋化因子域的接触。在基于细胞的CCR7和ACKR4活化检测中,我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。我们还发现,残基92-100降低了CCL21在钙通量,cAMP抑制和β-arrestin募集方面的效力。综上所述,这些结构功能研究支持了一种模型,其中分子内与柔性C端特定残基的相互作用稳定了CCL21活性较低的单体构象。我们推测,GAG结合和/或与CCR7受体的相互作用破坏了C末端尾巴与趋化因子之间的自抑制分子内接触,从而确保了最佳功能。











































 京公网安备 11010802027423号
京公网安备 11010802027423号