当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Role of Glycosaminoglycans in Procathepsin B Maturation: Molecular Mechanism Elucidated by a Computational Study.
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2020-03-10 , DOI: 10.1021/acs.jcim.0c00023 Krzysztof K Bojarski 1 , Agnieszka S Karczyńska 1 , Sergey A Samsonov 1
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2020-03-10 , DOI: 10.1021/acs.jcim.0c00023 Krzysztof K Bojarski 1 , Agnieszka S Karczyńska 1 , Sergey A Samsonov 1
Affiliation
|
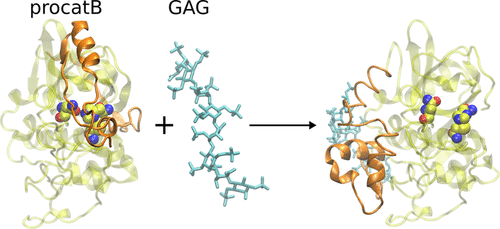
Procathepsins are an inactive, immature form of cathepsins, predominantly cysteine proteases present in the extracellular matrix (ECM) and in lysosomes that play a key role in various biological processes such as bone resorption or intracellular proteolysis. The enzymatic activity of cathepsins can be mediated by glycosaminoglycans (GAGs), long unbranched periodic negatively charged polysaccharides found in ECM that take part in many biological processes such as anticoagulation, angiogenesis, and tissue regeneration. In addition to the known effects on mature cathepsins, GAGs can mediate the maturation process of procathepsins, in particular, procathepsin B. However, the detailed mechanism of this mediation at the molecular level is still unknown. In this study, for the first time, we aimed to unravel the role of GAGs in this process using computational approaches. We rigorously analyzed procathepsin B-GAG complexes in terms of their dynamics, energetics, and potential allosteric regulation. We revealed that GAGs can stabilize the conformation of the procathepsin B structure with the active site accessible for the substrate and concluded that GAGs most probably bind to procathepsin B once the zymogen adopts the enzymatically active conformation. Our data provided a novel mechanistic view of the maturation process of procathepsin B, while the approaches elaborated here might be useful to study other procathepsins. Furthermore, our data can serve as a rational guide for experimental work on procathepsin-GAG systems that are not characterized in vivo and in vitro yet.
中文翻译:

糖胺聚糖在前蛋白酶B成熟中的作用:通过计算研究阐明的分子机理。
前列腺蛋白酶是组织蛋白酶的一种非活性,未成熟形式,主要存在于细胞外基质(ECM)和溶酶体中的半胱氨酸蛋白酶,它们在各种生物学过程(例如骨吸收或细胞内蛋白水解)中起关键作用。组织蛋白酶的酶活性可以由糖胺聚糖(GAGs)介导,这是在ECM中发现的长而无支链的周期性带负电荷的多糖,参与许多生物过程,例如抗凝,血管生成和组织再生。除了对成熟组织蛋白酶的已知作用外,GAG还可以介导原蛋白酶,特别是原蛋白酶B的成熟过程。但是,在分子水平上这种介导的详细机制仍然未知。在这项研究中,这是第一次 我们旨在使用计算方法来阐明GAG在此过程中的作用。我们从其动力学,能量学和潜在的变构调节方面严格分析了组织蛋白酶B-GAG复合物。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们从其动力学,能量学和潜在的变构调节方面严格分析了组织蛋白酶B-GAG复合物。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们从其动力学,能量学和潜在的变构调节方面严格分析了组织蛋白酶B-GAG复合物。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而本文阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可以作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而本文阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。
更新日期:2020-03-10
中文翻译:

糖胺聚糖在前蛋白酶B成熟中的作用:通过计算研究阐明的分子机理。
前列腺蛋白酶是组织蛋白酶的一种非活性,未成熟形式,主要存在于细胞外基质(ECM)和溶酶体中的半胱氨酸蛋白酶,它们在各种生物学过程(例如骨吸收或细胞内蛋白水解)中起关键作用。组织蛋白酶的酶活性可以由糖胺聚糖(GAGs)介导,这是在ECM中发现的长而无支链的周期性带负电荷的多糖,参与许多生物过程,例如抗凝,血管生成和组织再生。除了对成熟组织蛋白酶的已知作用外,GAG还可以介导原蛋白酶,特别是原蛋白酶B的成熟过程。但是,在分子水平上这种介导的详细机制仍然未知。在这项研究中,这是第一次 我们旨在使用计算方法来阐明GAG在此过程中的作用。我们从其动力学,能量学和潜在的变构调节方面严格分析了组织蛋白酶B-GAG复合物。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们从其动力学,能量学和潜在的变构调节方面严格分析了组织蛋白酶B-GAG复合物。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们从其动力学,能量学和潜在的变构调节方面严格分析了组织蛋白酶B-GAG复合物。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们发现,GAGs可以稳定底物可访问的活性位点,从而使蛋白酶组织B的结构稳定,并得出结论,一旦酶原采用酶活性构象,GAGs最有可能与蛋白酶组织B结合。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而本文阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而这里阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可以作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。我们的数据提供了一种新的机制蛋白酶原B的成熟过程,而本文阐述的方法可能对研究其他蛋白酶原可能有用。此外,我们的数据可作为尚未在体内和体外表征的组织蛋白酶-GAG系统的实验工作的合理指南。











































 京公网安备 11010802027423号
京公网安备 11010802027423号