当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Methionine Adenosyltransferase Engineering to Enable Bioorthogonal Platforms for AdoMet-Utilizing Enzymes.
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2020-03-03 , DOI: 10.1021/acschembio.9b00943 Tyler D Huber 1, 2 , Jonathan A Clinger , Yang Liu 1, 2 , Weijun Xu , Mitchell D Miller , George N Phillips , Jon S Thorson 1, 2
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2020-03-03 , DOI: 10.1021/acschembio.9b00943 Tyler D Huber 1, 2 , Jonathan A Clinger , Yang Liu 1, 2 , Weijun Xu , Mitchell D Miller , George N Phillips , Jon S Thorson 1, 2
Affiliation
|
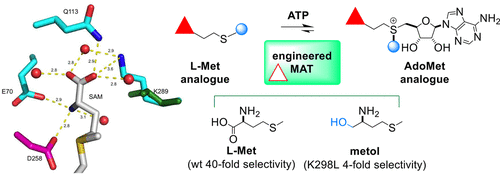
The structural conservation among methyltransferases (MTs) and MT functional redundancy is a major challenge to the cellular study of individual MTs. As a first step toward the development of an alternative biorthogonal platform for MTs and other AdoMet-utilizing enzymes, we describe the evaluation of 38 human methionine adenosyltransferase II-α (hMAT2A) mutants in combination with 14 non-native methionine analogues to identify suitable bioorthogonal mutant/analogue pairings. Enabled by the development and implementation of a hMAT2A high-throughput (HT) assay, this study revealed hMAT2A K289L to afford a 160-fold inversion of the hMAT2A selectivity index for a non-native methionine analogue over the native substrate l-Met. Structure elucidation of K289L revealed the mutant to be folded normally with minor observed repacking within the modified substrate pocket. This study highlights the first example of exchanging l-Met terminal carboxylate/amine recognition elements within the hMAT2A active-site to enable non-native bioorthgonal substrate utilization. Additionally, several hMAT2A mutants and l-Met substrate analogues produced AdoMet analogue products with increased stability. As many AdoMet-producing (e.g., hMAT2A) and AdoMet-utlizing (e.g., MTs) enzymes adopt similar active-site strategies for substrate recognition, the proof of concept first generation hMAT2A engineering highlighted herein is expected to translate to a range of AdoMet-utilizing target enzymes.
中文翻译:

蛋氨酸腺苷基转移酶工程技术能够为使用AdoMet的酶提供生物正交平台。
甲基转移酶(MT)和MT功能冗余之间的结构保守性是对单个MT进行细胞研究的主要挑战。作为开发MT和其他利用AdoMet的酶的替代生物正交平台的第一步,我们描述了结合38种人蛋氨酸腺苷基转移酶II-α(hMAT2A)突变体与14种非天然蛋氨酸类似物的鉴定,以鉴定合适的生物正交蛋白突变/模拟配对。通过开发和实施hMAT2A高通量(HT)分析,这项研究揭示了hMAT2A K289L相对于天然底物I-Met提供了非天然甲硫氨酸类似物的hMAT2A选择性指数的160倍反转。K289L的结构阐明揭示了该突变体可以正常折叠,而在修饰的底物袋中观察到的重新包装很少。这项研究突出了在hMAT2A活性位点之间交换l-Met末端羧酸盐/胺识别元素以实现非天然生物正交底物利用的第一个例子。另外,一些hMAT2A突变体和I-Met底物类似物产生具有增加的稳定性的AdoMet类似物产品。由于许多产生AdoMet的酶(例如hMAT2A)和使用AdoMet的酶(例如MTs)采用相似的活性位点策略进行底物识别,因此本文重点介绍的第一代hMAT2A工程学概念证明有望转化为一系列AdoMet-利用目标酶。这项研究突出了在hMAT2A活性位点之间交换l-Met末端羧酸盐/胺识别元素以实现非天然生物正交底物利用的第一个例子。另外,一些hMAT2A突变体和I-Met底物类似物产生具有增加的稳定性的AdoMet类似物产品。由于许多产生AdoMet的酶(例如hMAT2A)和使用AdoMet的酶(例如MTs)采用相似的活性位点策略进行底物识别,因此本文重点介绍的第一代hMAT2A工程学概念证明有望转化为一系列AdoMet-利用目标酶。这项研究突出了在hMAT2A活性位点之间交换l-Met末端羧酸盐/胺识别元素以实现非天然生物正交底物利用的第一个例子。另外,一些hMAT2A突变体和I-Met底物类似物产生具有增加的稳定性的AdoMet类似物产品。由于许多产生AdoMet的酶(例如hMAT2A)和使用AdoMet的酶(例如MTs)采用相似的活性位点策略进行底物识别,因此本文重点介绍的第一代hMAT2A工程学概念证明有望转化为一系列AdoMet-利用目标酶。
更新日期:2020-03-03
中文翻译:

蛋氨酸腺苷基转移酶工程技术能够为使用AdoMet的酶提供生物正交平台。
甲基转移酶(MT)和MT功能冗余之间的结构保守性是对单个MT进行细胞研究的主要挑战。作为开发MT和其他利用AdoMet的酶的替代生物正交平台的第一步,我们描述了结合38种人蛋氨酸腺苷基转移酶II-α(hMAT2A)突变体与14种非天然蛋氨酸类似物的鉴定,以鉴定合适的生物正交蛋白突变/模拟配对。通过开发和实施hMAT2A高通量(HT)分析,这项研究揭示了hMAT2A K289L相对于天然底物I-Met提供了非天然甲硫氨酸类似物的hMAT2A选择性指数的160倍反转。K289L的结构阐明揭示了该突变体可以正常折叠,而在修饰的底物袋中观察到的重新包装很少。这项研究突出了在hMAT2A活性位点之间交换l-Met末端羧酸盐/胺识别元素以实现非天然生物正交底物利用的第一个例子。另外,一些hMAT2A突变体和I-Met底物类似物产生具有增加的稳定性的AdoMet类似物产品。由于许多产生AdoMet的酶(例如hMAT2A)和使用AdoMet的酶(例如MTs)采用相似的活性位点策略进行底物识别,因此本文重点介绍的第一代hMAT2A工程学概念证明有望转化为一系列AdoMet-利用目标酶。这项研究突出了在hMAT2A活性位点之间交换l-Met末端羧酸盐/胺识别元素以实现非天然生物正交底物利用的第一个例子。另外,一些hMAT2A突变体和I-Met底物类似物产生具有增加的稳定性的AdoMet类似物产品。由于许多产生AdoMet的酶(例如hMAT2A)和使用AdoMet的酶(例如MTs)采用相似的活性位点策略进行底物识别,因此本文重点介绍的第一代hMAT2A工程学概念证明有望转化为一系列AdoMet-利用目标酶。这项研究突出了在hMAT2A活性位点之间交换l-Met末端羧酸盐/胺识别元素以实现非天然生物正交底物利用的第一个例子。另外,一些hMAT2A突变体和I-Met底物类似物产生具有增加的稳定性的AdoMet类似物产品。由于许多产生AdoMet的酶(例如hMAT2A)和使用AdoMet的酶(例如MTs)采用相似的活性位点策略进行底物识别,因此本文重点介绍的第一代hMAT2A工程学概念证明有望转化为一系列AdoMet-利用目标酶。











































 京公网安备 11010802027423号
京公网安备 11010802027423号