当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Role of α-Synuclein Regions in Nucleation and Elongation of Amyloid Fiber Assembly.
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2020-03-04 , DOI: 10.1021/acschemneuro.9b00527 José Gallardo 1 , Carmen Escalona-Noguero 1 , Begoña Sot 1, 2
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2020-03-04 , DOI: 10.1021/acschemneuro.9b00527 José Gallardo 1 , Carmen Escalona-Noguero 1 , Begoña Sot 1, 2
Affiliation
|
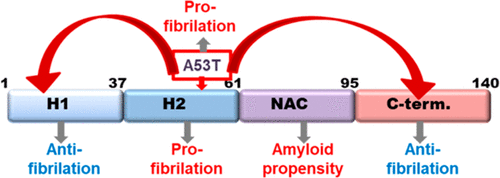
α-Synuclein is an intrinsically disordered protein whose aggregation in the form of amyloid fibers is directly implicated in Parkinson's disease and other neurological disorders. α-Synuclein is composed of three different regions. The central region (61-95), called NAC, is responsible for protein fibrillation. The N-terminal region (1-61) has some helical propensity and can be divided into H1 (1-31) and H2 (32-61), while the highly acidic C-terminal region (96-140) is completely disordered. It has been postulated that the acidic character of the C-terminus, as well as the interaction between the soluble N- and C- terminal parts, protects the NAC region from fibrillation. In consequence, N- and C-terminal deletions increase α-synuclein fibrillation. Both N- and C-terminal truncations are common in synucleinopathies, but despite their clinical relevance, to date, there are no systematic and exhaustive studies that quantify the effect of these truncations in fiber nucleation and elongation. In this work, we measured both nucleation and fibrillation elongation kinetics in order to study the influence of N- and C-terminal deletions, including the simultaneous deletion of several regions, in α-synuclein fibrillation. We also tested whether the fibrillation prone mutation A53T had an additional effect when combined with truncations. Furthermore, our cross-seeding experiments showed that the deletions studied induce changes in fiber morphology. Our results unravel then the role of the different α-synuclein regions and the A53T mutation in the nucleation and elongation of amyloid fibers.
中文翻译:

α-突触核蛋白区域在淀粉样蛋白纤维组装成核和伸长中的作用。
α-突触核蛋白是一种内在失调的蛋白质,其淀粉状蛋白纤维形式的聚集直接与帕金森氏病和其他神经系统疾病有关。α-突触核蛋白由三个不同区域组成。称为NAC的中部区域(61-95)负责蛋白原纤化。N末端区域(1-61)具有一定的螺旋倾向,可以分为H1(1-31)和H2(32-61),而高酸性C末端区域(96-140)则完全无序。据推测,C末端的酸性以及可溶性N末端和C末端之间的相互作用可保护NAC区免于原纤化。结果,N端和C端缺失增加了α-突触核蛋白的纤颤。N端和C端截短在突触核蛋白病中很常见,但是,尽管它们具有临床相关性,但迄今为止,还没有系统和详尽的研究来量化这些截短在纤维成核和伸长中的作用。在这项工作中,我们测量了成核和原纤化伸长动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。没有系统和详尽的研究来量化这些截断在纤维成核和伸长中的作用。在这项工作中,我们测量了成核和原纤化伸长动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。没有系统和详尽的研究来量化这些截断在纤维成核和伸长中的作用。在这项工作中,我们测量了成核和原纤化伸长动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们研究了成核和原纤化延伸动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们研究了成核和原纤化延伸动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。
更新日期:2020-03-04
中文翻译:

α-突触核蛋白区域在淀粉样蛋白纤维组装成核和伸长中的作用。
α-突触核蛋白是一种内在失调的蛋白质,其淀粉状蛋白纤维形式的聚集直接与帕金森氏病和其他神经系统疾病有关。α-突触核蛋白由三个不同区域组成。称为NAC的中部区域(61-95)负责蛋白原纤化。N末端区域(1-61)具有一定的螺旋倾向,可以分为H1(1-31)和H2(32-61),而高酸性C末端区域(96-140)则完全无序。据推测,C末端的酸性以及可溶性N末端和C末端之间的相互作用可保护NAC区免于原纤化。结果,N端和C端缺失增加了α-突触核蛋白的纤颤。N端和C端截短在突触核蛋白病中很常见,但是,尽管它们具有临床相关性,但迄今为止,还没有系统和详尽的研究来量化这些截短在纤维成核和伸长中的作用。在这项工作中,我们测量了成核和原纤化伸长动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。没有系统和详尽的研究来量化这些截断在纤维成核和伸长中的作用。在这项工作中,我们测量了成核和原纤化伸长动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。没有系统和详尽的研究来量化这些截断在纤维成核和伸长中的作用。在这项工作中,我们测量了成核和原纤化伸长动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们研究了成核和原纤化延伸动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们研究了成核和原纤化延伸动力学,以研究α-突触核蛋白原纤化过程中N和C端缺失(包括多个区域的同时缺失)的影响。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。我们还测试了与截短结合使用时,原发性纤维突变倾向A53T是否具有其他作用。此外,我们的交叉播种实验表明,研究的缺失诱导了纤维形态的变化。我们的研究结果揭示了不同的α-突触核蛋白区域和A53T突变在淀粉样蛋白纤维的成核和伸长中的作用。











































 京公网安备 11010802027423号
京公网安备 11010802027423号