当前位置:
X-MOL 学术
›
J. Mol. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Function of Auxiliary Domains of the DEAH/RHA Helicase DHX36 in RNA Remodeling.
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2020-02-19 , DOI: 10.1016/j.jmb.2020.02.005 Sukanya Srinivasan 1 , Zhonghua Liu 2 , Watchalee Chuenchor 3 , Tsan Sam Xiao 4 , Eckhard Jankowsky 5
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2020-02-19 , DOI: 10.1016/j.jmb.2020.02.005 Sukanya Srinivasan 1 , Zhonghua Liu 2 , Watchalee Chuenchor 3 , Tsan Sam Xiao 4 , Eckhard Jankowsky 5
Affiliation
|
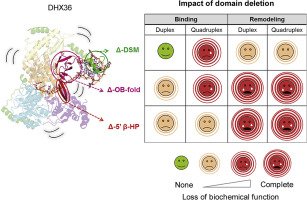
The DEAH/RHA helicase DHX36 has been linked to cellular RNA and DNA quadruplex structures and to AU-rich RNA elements. In vitro, DHX36 remodels DNA and RNA quadruplex structures and unwinds DNA duplexes in an ATP-dependent manner. DHX36 contains the superfamily 2 helicase core and several auxiliary domains that are conserved in orthologs of the enzyme. The role of these auxiliary domains for the enzymatic function of DHX36 is not well understood. Here, we combine structural and biochemical studies to define the function of three auxiliary domains that contact nucleic acid. We first report the crystal structure of mouse DHX36 bound to ADP. The structure reveals an overall architecture of mouse DHX36 that is similar to previously reported architectures of fly and bovine DHX36. In addition, our structure shows conformational changes that accompany stages of the ATP-binding and hydrolysis cycle. We then examine the roles of the DHX36-specific motif (DSM), the OB-fold, and a conserved β-hairpin (β-HP) in mouse DHX36 in the remodeling of RNA structures. We demonstrate and characterize RNA duplex unwinding for DHX36 and examine the remodeling of inter- and intramolecular RNA quadruplex structures. We find that the DSM not only functions as a quadruplex binding adaptor but also promotes the remodeling of RNA duplex and quadruplex structures. The OB-fold and the β-HP contribute to RNA binding. Both domains are also essential for remodeling RNA quadruplex and duplex structures. Our data reveal roles of auxiliary domains for multiple steps of the nucleic acid remodeling reactions.
中文翻译:

DEAH / RHA解旋酶DHX36的辅助结构域在RNA重塑中的功能。
DEAH / RHA解旋酶DHX36已与细胞RNA和DNA四链体结构以及富含AU的RNA元件连接。在体外,DHX36重塑DNA和RNA四链体结构,并以ATP依赖性方式解开DNA双链体。DHX36包含超家族2解旋酶核心和在该酶的直系同源物中保守的几个辅助结构域。这些辅助域对于DHX36的酶促功能的作用尚不清楚。在这里,我们结合结构和生化研究来定义接触核酸的三个辅助结构域的功能。我们首先报告与ADP结合的小鼠DHX36的晶体结构。该结构揭示了小鼠DHX36的总体架构,该架构类似于先前报道的苍蝇和牛DHX36的架构。此外,我们的结构显示了ATP结合和水解循环阶段所伴随的构象变化。然后,我们检查了DHX36特异性基序(DSM),OB折叠和保守的β-发夹(β-HP)在小鼠DHX36中在RNA结构重塑中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。然后,我们检查了DHX36特异性基序(DSM),OB折叠和保守的β-发夹(β-HP)在小鼠DHX36中在RNA结构重塑中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。然后,我们检查了DHX36特异性基序(DSM),OB折叠和保守的β-发夹(β-HP)在小鼠DHX36中在RNA结构重塑中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。
更新日期:2020-02-20
中文翻译:

DEAH / RHA解旋酶DHX36的辅助结构域在RNA重塑中的功能。
DEAH / RHA解旋酶DHX36已与细胞RNA和DNA四链体结构以及富含AU的RNA元件连接。在体外,DHX36重塑DNA和RNA四链体结构,并以ATP依赖性方式解开DNA双链体。DHX36包含超家族2解旋酶核心和在该酶的直系同源物中保守的几个辅助结构域。这些辅助域对于DHX36的酶促功能的作用尚不清楚。在这里,我们结合结构和生化研究来定义接触核酸的三个辅助结构域的功能。我们首先报告与ADP结合的小鼠DHX36的晶体结构。该结构揭示了小鼠DHX36的总体架构,该架构类似于先前报道的苍蝇和牛DHX36的架构。此外,我们的结构显示了ATP结合和水解循环阶段所伴随的构象变化。然后,我们检查了DHX36特异性基序(DSM),OB折叠和保守的β-发夹(β-HP)在小鼠DHX36中在RNA结构重塑中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。然后,我们检查了DHX36特异性基序(DSM),OB折叠和保守的β-发夹(β-HP)在小鼠DHX36中在RNA结构重塑中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。然后,我们检查了DHX36特异性基序(DSM),OB折叠和保守的β-发夹(β-HP)在小鼠DHX36中在RNA结构重塑中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。我们证明和表征DHX36的RNA双链体展开,并检查分子间和分子内RNA四链体结构的重塑。我们发现DSM不仅充当四链体结合衔接子,而且还促进了RNA双链体和四链体结构的重塑。OB折叠和β-HP有助于RNA结合。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。这两个域对于重构RNA四链体和双链体结构也是必不可少的。我们的数据揭示了辅助结构域在核酸重塑反应的多个步骤中的作用。











































 京公网安备 11010802027423号
京公网安备 11010802027423号