Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Effect of Intravenous Interferon β-1a on Death and Days Free From Mechanical Ventilation Among Patients With Moderate to Severe Acute Respiratory Distress Syndrome
JAMA ( IF 63.1 ) Pub Date : 2020-02-25 , DOI: 10.1001/jama.2019.22525 V Marco Ranieri 1 , Ville Pettilä 2 , Matti K Karvonen 3 , Juho Jalkanen 3 , Peter Nightingale 4 , David Brealey 5 , Jordi Mancebo 6 , Ricard Ferrer 7 , Alain Mercat 8 , Nicolò Patroniti 9 , Michael Quintel 10 , Jean-Louis Vincent 11 , Marjatta Okkonen 2 , Ferhat Meziani 12 , Giacomo Bellani 13 , Niall MacCallum 5 , Jacques Creteur 11 , Stefan Kluge 14 , Antonio Artigas-Raventos 15 , Mikael Maksimow 3 , Ilse Piippo 3 , Kati Elima 16 , Sirpa Jalkanen 16 , Markku Jalkanen 3 , Geoff Bellingan 5 ,
JAMA ( IF 63.1 ) Pub Date : 2020-02-25 , DOI: 10.1001/jama.2019.22525 V Marco Ranieri 1 , Ville Pettilä 2 , Matti K Karvonen 3 , Juho Jalkanen 3 , Peter Nightingale 4 , David Brealey 5 , Jordi Mancebo 6 , Ricard Ferrer 7 , Alain Mercat 8 , Nicolò Patroniti 9 , Michael Quintel 10 , Jean-Louis Vincent 11 , Marjatta Okkonen 2 , Ferhat Meziani 12 , Giacomo Bellani 13 , Niall MacCallum 5 , Jacques Creteur 11 , Stefan Kluge 14 , Antonio Artigas-Raventos 15 , Mikael Maksimow 3 , Ilse Piippo 3 , Kati Elima 16 , Sirpa Jalkanen 16 , Markku Jalkanen 3 , Geoff Bellingan 5 ,
Affiliation
|
Importance
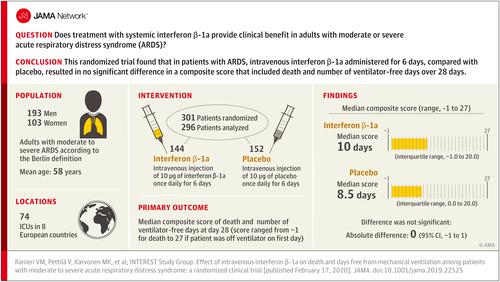
Acute respiratory distress syndrome (ARDS) is associated with high mortality. Interferon (IFN) β-1a may prevent the underlying event of vascular leakage. Objective
To determine the efficacy and adverse events of IFN-β-1a in patients with moderate to severe ARDS. Design, Setting, and Participants
Multicenter, randomized, double-blind, parallel-group trial conducted at 74 intensive care units in 8 European countries (December 2015-December 2017) that included 301 adults with moderate to severe ARDS according to the Berlin definition. The radiological and partial pressure of oxygen, arterial (Pao2)/fraction of inspired oxygen (Fio2) criteria for ARDS had to be met within a 24-hour period, and the administration of the first dose of the study drug had to occur within 48 hours of the diagnosis of ARDS. The last patient visit was on March 6, 2018. Interventions
Patients were randomized to receive an intravenous injection of 10 μg of IFN-β-1a (144 patients) or placebo (152 patients) once daily for 6 days. Main Outcomes and Measures
The primary outcome was a score combining death and number of ventilator-free days at day 28 (score ranged from -1 for death to 27 if the patient was off ventilator on the first day). There were 16 secondary outcomes, including 28-day mortality, which were tested hierarchically to control type I error. Results
Among 301 patients who were randomized (mean age, 58 years; 103 women [34.2%]), 296 (98.3%) completed the trial and were included in the primary analysis. At 28 days, the median composite score of death and number of ventilator-free days at day 28 was 10 days (interquartile range, -1 to 20) in the IFN-β-1a group and 8.5 days (interquartile range, 0 to 20) in the placebo group (P = .82). There was no significant difference in 28-day mortality between the IFN-β-1a vs placebo groups (26.4% vs 23.0%; difference, 3.4% [95% CI, -8.1% to 14.8%]; P = .53). Seventy-four patients (25.0%) experienced adverse events considered to be related to treatment during the study (41 patients [28.5%] in the IFN-β-1a group and 33 [21.7%] in the placebo group). Conclusions and Relevance
Among adults with moderate or severe ARDS, intravenous IFN-β-1a administered for 6 days, compared with placebo, resulted in no significant difference in a composite score that included death and number of ventilator-free days over 28 days. These results do not support the use of IFN-β-1a in the management of ARDS. Trial Registration
ClinicalTrials.gov Identifier: NCT02622724.
中文翻译:

静脉注射干扰素 β-1a 对中重度急性呼吸窘迫综合征患者死亡和机械通气天数的影响
重要性 急性呼吸窘迫综合征 (ARDS) 与高死亡率有关。干扰素 (IFN) β-1a 可以预防潜在的血管渗漏事件。目的确定IFN-β-1a对中重度ARDS患者的疗效和不良反应。设计、设置和参与者 在 8 个欧洲国家(2015 年 12 月至 2017 年 12 月)的 74 个重症监护病房进行的多中心、随机、双盲、平行组试验,包括 301 名符合柏林定义的中度至重度 ARDS 成人。必须在 24 小时内满足 ARDS 的放射学和氧分压、动脉 (Pao2)/吸入氧分数 (Fio2) 标准,并且必须在 48 小时内施用第一剂研究药物ARDS 的诊断时间。最后一次患者就诊是在 3 月 6 日,2018. 干预 患者随机接受静脉注射 10 μg IFN-β-1a(144 名患者)或安慰剂(152 名患者),每天一次,持续 6 天。主要结果和测量 主要结果是结合死亡和第 28 天不使用呼吸机天数的评分(评分范围从死亡的 -1 到 27,如果患者在第一天不使用呼吸机)。有 16 个次要结果,包括 28 天死亡率,这些结果经过分层测试以控制 I 类错误。结果 在随机分组的 301 名患者(平均年龄 58 岁;103 名女性 [34.2%])中,296 名(98.3%)完成了试验并被纳入了主要分析。在第 28 天,IFN-β-1a 组的死亡和第 28 天无呼吸机天数的中位综合评分为 10 天(四分位距,-1 至 20)和 8.5 天(四分位距,0 到 20)在安慰剂组(P = .82)。IFN-β-1a 组与安慰剂组之间的 28 天死亡率无显着差异(26.4% 与 23.0%;差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。IFN-β-1a 组与安慰剂组之间的 28 天死亡率无显着差异(26.4% 与 23.0%;差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。IFN-β-1a 组与安慰剂组之间的 28 天死亡率无显着差异(26.4% 与 23.0%;差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。5%] 在 IFN-β-1a 组和 33 [21.7%] 在安慰剂组)。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。5%] 在 IFN-β-1a 组和 33 [21.7%] 在安慰剂组)。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。
更新日期:2020-02-25
中文翻译:

静脉注射干扰素 β-1a 对中重度急性呼吸窘迫综合征患者死亡和机械通气天数的影响
重要性 急性呼吸窘迫综合征 (ARDS) 与高死亡率有关。干扰素 (IFN) β-1a 可以预防潜在的血管渗漏事件。目的确定IFN-β-1a对中重度ARDS患者的疗效和不良反应。设计、设置和参与者 在 8 个欧洲国家(2015 年 12 月至 2017 年 12 月)的 74 个重症监护病房进行的多中心、随机、双盲、平行组试验,包括 301 名符合柏林定义的中度至重度 ARDS 成人。必须在 24 小时内满足 ARDS 的放射学和氧分压、动脉 (Pao2)/吸入氧分数 (Fio2) 标准,并且必须在 48 小时内施用第一剂研究药物ARDS 的诊断时间。最后一次患者就诊是在 3 月 6 日,2018. 干预 患者随机接受静脉注射 10 μg IFN-β-1a(144 名患者)或安慰剂(152 名患者),每天一次,持续 6 天。主要结果和测量 主要结果是结合死亡和第 28 天不使用呼吸机天数的评分(评分范围从死亡的 -1 到 27,如果患者在第一天不使用呼吸机)。有 16 个次要结果,包括 28 天死亡率,这些结果经过分层测试以控制 I 类错误。结果 在随机分组的 301 名患者(平均年龄 58 岁;103 名女性 [34.2%])中,296 名(98.3%)完成了试验并被纳入了主要分析。在第 28 天,IFN-β-1a 组的死亡和第 28 天无呼吸机天数的中位综合评分为 10 天(四分位距,-1 至 20)和 8.5 天(四分位距,0 到 20)在安慰剂组(P = .82)。IFN-β-1a 组与安慰剂组之间的 28 天死亡率无显着差异(26.4% 与 23.0%;差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。IFN-β-1a 组与安慰剂组之间的 28 天死亡率无显着差异(26.4% 与 23.0%;差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。IFN-β-1a 组与安慰剂组之间的 28 天死亡率无显着差异(26.4% 与 23.0%;差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。差异,3.4% [95% CI,-8.1% 至 14.8%];P = .53)。74 名患者 (25.0%) 在研究期间经历了被认为与治疗相关的不良事件(IFN-β-1a 组 41 名患者 [28.5%] 和安慰剂组 33 名患者 [21.7%])。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。5%] 在 IFN-β-1a 组和 33 [21.7%] 在安慰剂组)。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。5%] 在 IFN-β-1a 组和 33 [21.7%] 在安慰剂组)。结论和相关性 在患有中度或重度 ARDS 的成人中,与安慰剂相比,静脉注射 6 天的 IFN-β-1a 导致包括死亡和 28 天以上无呼吸机天数在内的综合评分无显着差异。这些结果不支持在 ARDS 管理中使用 IFN-β-1a。试验注册 ClinicalTrials.gov 标识符:NCT02622724。











































 京公网安备 11010802027423号
京公网安备 11010802027423号