当前位置:
X-MOL 学术
›
J. Control. Release
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ligand-installed anti-VEGF genomic nanocarriers for effective gene therapy of primary and metastatic tumors.
Journal of Controlled Release ( IF 10.5 ) Pub Date : 2020-01-16 , DOI: 10.1016/j.jconrel.2020.01.026 Huaping Zhang 1 , Jing Liu 1 , Qixian Chen 2 , Peng Mi 1
Journal of Controlled Release ( IF 10.5 ) Pub Date : 2020-01-16 , DOI: 10.1016/j.jconrel.2020.01.026 Huaping Zhang 1 , Jing Liu 1 , Qixian Chen 2 , Peng Mi 1
Affiliation
|
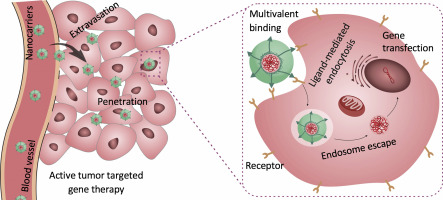
The systemic dosage regimen exhibited low therapeutic efficacy and incurred severe adverse effect, thus, the development of tumor-targeted therapeutics is crucial important for tumor precision therapy. Herein, the active targeted modulation of tumor microenvironments was schemed by developing hyaluronic acid-installed genomic nanocarriers (HA-NPs) for effectively ablation of both primary and metastatic tumors through anti-vascular endothelial growth factor (anti-VEGF) approach. The anti-VEGF genomic payloads were strategically packaged into the well-defined synthetic nanocarriers by layer-by-layer preparation strategy, exhibiting high colloidal stability and much lower cell viability than the cationic gene carriers. Besides, the HA-NPs could specifically and efficiently internalize with cancer cells for efficient intracellular gene delivery, leading to high gene transfection efficacy. Moreover, it further demonstrated efficient extravasation, high accumulation and deep penetration in tumors, which markedly facilitated tumor-targeted expression of anti-VEGF genomic payloads for inhabitation of neo-vasculature, consecutively contributing to potent ablation of solid tumors. In addition, the ligand-installed nanocarriers facilitated systemic treatment of melanoma lung metastasis by the expressed anti-VEGF proteins, which were extensively spread along blood circulation and metastatic niches to diminish the formation of neovasculature for tumorigenesis. Therefore, the proposed anti-VEGF genomic nanocarriers could shed intriguing implication in effectively treatment of primary tumors and metastasis.
中文翻译:

配体安装的抗VEGF基因组纳米载体可有效治疗原发性和转移性肿瘤。
全身给药方案显示出低的治疗效果并引起严重的不良反应,因此,靶向肿瘤的治疗方法的开发对于肿瘤精确治疗至关重要。本文中,通过开发透明质酸安装的基因组纳米载体(HA-NP),通过抗血管内皮生长因子(anti-VEGF)方法有效消融原发性和转移性肿瘤,从而对肿瘤微环境进行主动靶向调节。通过层层制备策略,将抗VEGF基因组有效载荷策略性地包装到定义明确的合成纳米载体中,与阳离子基因载体相比,具有较高的胶体稳定性和更低的细胞活力。此外,HA-NPs可以特异性并有效地与癌细胞内在化,从而有效地进行细胞内基因传递,导致高基因转染功效。而且,它进一步证明了在肿瘤中的有效外渗,高积累和深度渗透,这显着促进了针对肿瘤的抗-VEGF基因组有效载荷的表达,以用于新脉管系统的居住,从而连续地促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它进一步证明了在肿瘤中的有效外渗,高积累和深度渗透,这显着促进了针对肿瘤定位的抗-VEGF基因组有效载荷在新血管系统中的表达,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它进一步证明了在肿瘤中的有效外渗,高积累和深度渗透,这显着促进了针对肿瘤定位的抗-VEGF基因组有效载荷在新血管系统中的表达,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它显着促进了针对肿瘤的抗VEGF基因组有效载荷的表达,以适应新脉管系统的生长,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它显着促进了针对肿瘤的抗VEGF基因组有效载荷的表达,以适应新脉管系统的生长,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它们沿血液循环和转移性小生境广泛传播,以减少用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它们沿血液循环和转移性小生境广泛传播,以减少用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。
更新日期:2020-01-17
中文翻译:

配体安装的抗VEGF基因组纳米载体可有效治疗原发性和转移性肿瘤。
全身给药方案显示出低的治疗效果并引起严重的不良反应,因此,靶向肿瘤的治疗方法的开发对于肿瘤精确治疗至关重要。本文中,通过开发透明质酸安装的基因组纳米载体(HA-NP),通过抗血管内皮生长因子(anti-VEGF)方法有效消融原发性和转移性肿瘤,从而对肿瘤微环境进行主动靶向调节。通过层层制备策略,将抗VEGF基因组有效载荷策略性地包装到定义明确的合成纳米载体中,与阳离子基因载体相比,具有较高的胶体稳定性和更低的细胞活力。此外,HA-NPs可以特异性并有效地与癌细胞内在化,从而有效地进行细胞内基因传递,导致高基因转染功效。而且,它进一步证明了在肿瘤中的有效外渗,高积累和深度渗透,这显着促进了针对肿瘤的抗-VEGF基因组有效载荷的表达,以用于新脉管系统的居住,从而连续地促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它进一步证明了在肿瘤中的有效外渗,高积累和深度渗透,这显着促进了针对肿瘤定位的抗-VEGF基因组有效载荷在新血管系统中的表达,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它进一步证明了在肿瘤中的有效外渗,高积累和深度渗透,这显着促进了针对肿瘤定位的抗-VEGF基因组有效载荷在新血管系统中的表达,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它显着促进了针对肿瘤的抗VEGF基因组有效载荷的表达,以适应新脉管系统的生长,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它显着促进了针对肿瘤的抗VEGF基因组有效载荷的表达,以适应新脉管系统的生长,从而继续促进了实体瘤的有效消融。此外,安装有配体的纳米载体通过表达的抗VEGF蛋白促进了黑素瘤肺转移的系统治疗,该蛋白在血液循环和转移性壁ni中广泛传播,从而减少了用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它们沿血液循环和转移性小生境广泛传播,以减少用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。它们沿血液循环和转移性小生境广泛传播,以减少用于肿瘤发生的新脉管系统的形成。因此,所提出的抗VEGF基因组纳米载体可以有效地治疗原发性肿瘤和转移灶。











































 京公网安备 11010802027423号
京公网安备 11010802027423号