当前位置:
X-MOL 学术
›
J. Proteome Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Elucidating Proteoform Dynamics Underlying the Senescence Associated Secretory Phenotype.
Journal of Proteome Research ( IF 4.4 ) Pub Date : 2020-01-28 , DOI: 10.1021/acs.jproteome.9b00739 Peter F Doubleday 1 , Luca Fornelli 2 , Neil L Kelleher 1
Journal of Proteome Research ( IF 4.4 ) Pub Date : 2020-01-28 , DOI: 10.1021/acs.jproteome.9b00739 Peter F Doubleday 1 , Luca Fornelli 2 , Neil L Kelleher 1
Affiliation
|
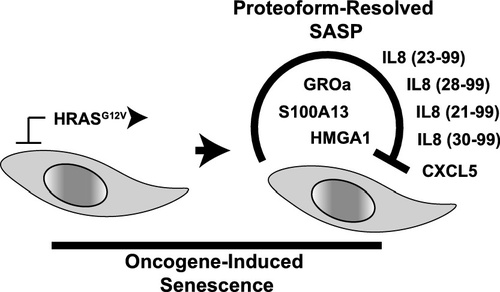
Primary diploid cells exit the cell cycle in response to exogenous stress or oncogene activation through a process known as cellular senescence. This cell-autonomous tumor-suppressive mechanism is also a major mechanism operative in organismal aging. To date, temporal aspects of senescence remain understudied. Therefore, we use quantitative proteomics to investigate changes following forced HRASG12V expression and induction of senescence across 1 week in normal diploid fibroblasts. We demonstrate that global intracellular proteomic changes correlate with the emergence of the senescence-associated secretory phenotype and the switch to robust cell cycle exit. The senescence secretome reinforces cell cycle exit, yet is largely detrimental to tissue homeostasis. Previous studies of secretomes rely on ELISA, bottom-up proteomics or RNA-seq. To date, no study to date has examined the proteoform complexity of secretomes to elucidate isoform-specific, post-translational modifications or regulated cleavage of signal peptides. Therefore, we use a quantitative top-down proteomics approach to define the molecular complexity of secreted proteins <30 kDa. We identify multiple forms of immune regulators with known activities and affinities such as distinct forms of interleukin-8, as well as GROα and HMGA1, and temporally resolve secreted proteoform dynamics. Together, our work demonstrates the complexity of the secretome past individual protein accessions and provides motivation for further proteoform-resolved measurements of the secretome.
中文翻译:

阐明衰老相关的蛋白质表型背后的蛋白形式动力学。
原二倍体细胞通过称为细胞衰老的过程响应外源性应激或癌基因激活而退出细胞周期。这种细胞自主的肿瘤抑制机制也是在机体衰老中起作用的主要机制。迄今为止,衰老的时间方面仍未得到充分研究。因此,我们使用定量蛋白质组学来研究正常二倍体成纤维细胞经过1周强迫HRASG12V表达和诱导衰老后的变化。我们证明全球细胞内蛋白质组学变化与衰老相关的分泌表型的出现和向稳健的细胞周期出口的转换相关。衰老的分泌组增强了细胞周期的退出,但对组织动态平衡却是有害的。先前有关分泌组的研究依靠ELISA,自下而上的蛋白质组学或RNA-seq。至今,迄今为止,尚无研究检查分泌蛋白组的蛋白形式复杂性,以阐明异构体特异性,翻译后修饰或信号肽的调控切割。因此,我们使用定量的自上而下的蛋白质组学方法来定义<30 kDa的分泌蛋白的分子复杂性。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。翻译后修饰或信号肽的调控切割。因此,我们使用定量的自上而下的蛋白质组学方法来定义<30 kDa的分泌蛋白的分子复杂性。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。翻译后修饰或信号肽的调控切割。因此,我们使用定量的自上而下的蛋白质组学方法来定义<30 kDa的分泌蛋白的分子复杂性。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如不同形式的白细胞介素8,以及GROα和HMGA1,并暂时解析分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入的复杂性,并为进一步用蛋白形式解析的分泌蛋白测量提供了动力。
更新日期:2020-01-29
中文翻译:

阐明衰老相关的蛋白质表型背后的蛋白形式动力学。
原二倍体细胞通过称为细胞衰老的过程响应外源性应激或癌基因激活而退出细胞周期。这种细胞自主的肿瘤抑制机制也是在机体衰老中起作用的主要机制。迄今为止,衰老的时间方面仍未得到充分研究。因此,我们使用定量蛋白质组学来研究正常二倍体成纤维细胞经过1周强迫HRASG12V表达和诱导衰老后的变化。我们证明全球细胞内蛋白质组学变化与衰老相关的分泌表型的出现和向稳健的细胞周期出口的转换相关。衰老的分泌组增强了细胞周期的退出,但对组织动态平衡却是有害的。先前有关分泌组的研究依靠ELISA,自下而上的蛋白质组学或RNA-seq。至今,迄今为止,尚无研究检查分泌蛋白组的蛋白形式复杂性,以阐明异构体特异性,翻译后修饰或信号肽的调控切割。因此,我们使用定量的自上而下的蛋白质组学方法来定义<30 kDa的分泌蛋白的分子复杂性。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。翻译后修饰或信号肽的调控切割。因此,我们使用定量的自上而下的蛋白质组学方法来定义<30 kDa的分泌蛋白的分子复杂性。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。翻译后修饰或信号肽的调控切割。因此,我们使用定量的自上而下的蛋白质组学方法来定义<30 kDa的分泌蛋白的分子复杂性。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如不同形式的白细胞介素8,以及GROα和HMGA1,并暂时解析分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入后的复杂性,并为进一步通过蛋白形式解析的分泌蛋白测量提供了动力。我们确定具有已知活性和亲和力的多种形式的免疫调节剂,例如白细胞介素8,GROα和HMGA1的不同形式,并暂时解决分泌的蛋白形式动力学。在一起,我们的工作证明了分泌蛋白过去单个蛋白质加入的复杂性,并为进一步用蛋白形式解析的分泌蛋白测量提供了动力。



























 京公网安备 11010802027423号
京公网安备 11010802027423号