当前位置:
X-MOL 学术
›
Food Hydrocoll.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
The protection of bovine serum albumin against thermal denaturation and gelation by sodium dodecyl sulfate studied by rheology and molecular dynamics simulation
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2020-06-01 , DOI: 10.1016/j.foodhyd.2020.105656 Osita Sunday Nnyigide , Kyu Hyun
Food Hydrocolloids ( IF 11.0 ) Pub Date : 2020-06-01 , DOI: 10.1016/j.foodhyd.2020.105656 Osita Sunday Nnyigide , Kyu Hyun
|
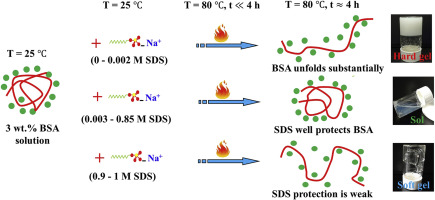
Abstract It is well known that when bovine serum albumin (BSA) protein in aqueous solution is heated above the protein denaturation temperature which is typically > 65 °C, the protein unfolds substantially and under continuous heating the unfolded protein aggregates to form a gel. In contrast to conventional wisdom, however, we show that sodium dodecyl sulfate (SDS) can protect BSA against thermal denaturation and gelation at specific concentration range, using 0–1 M SDS and 3, 5 and 7 wt% BSA concentrations. The SDS protective effect which was investigated by time sweep test at 80 °C, increased with the SDS concentration up to 0.85, 0.7 and 0.4 M at 3, 5 and 7 wt% BSA solutions, respectively. Beyond these specified concentrations, the SDS protective effect decreased. The increase or decrease in the protective effect was further confirmed by the frequency sweep test carried out on the pure BSA and BSA/SDS solutions at 80 °C. The frequency sweep test showed that the value of the storage modulus (G′) without the protective effect was more than 3 orders of magnitude larger than its value when the BSA was completely protected from thermal gelation. In order to interpret the SDS effects at the atomic/molecular level, molecular dynamics (MD) simulation was applied to identify the helices of the BSA that were protected in thermal denaturation at 80 °C. The molecular mechanism whereby SDS protects the BSA helices was established as a bridging interaction between the SDS ion and some helical moieties of the BSA.
中文翻译:

流变学和分子动力学模拟研究十二烷基硫酸钠对牛血清白蛋白热变性和凝胶化的保护作用
摘要 众所周知,当水溶液中的牛血清白蛋白 (BSA) 蛋白质被加热到高于蛋白质变性温度(通常 > 65 °C)时,蛋白质会大量展开,并在持续加热下展开的蛋白质聚集形成凝胶。然而,与传统观点相反,我们表明十二烷基硫酸钠 (SDS) 可以在特定浓度范围内保护 BSA 免受热变性和凝胶化,使用 0-1 M SDS 和 3、5 和 7 wt% 的 BSA 浓度。在 80 °C 下通过时间扫描测试研究的 SDS 保护作用随着 SDS 浓度分别增加至 0.85、0.7 和 0.4 M(在 3、5 和 7 wt% BSA 溶液中)而增加。超过这些指定的浓度,SDS 保护作用下降。通过在 80°C 下对纯 BSA 和 BSA/SDS 溶液进行的频率扫描测试进一步证实了保护作用的增加或减少。扫频测试表明,没有保护作用的储能模量(G')值比完全保护 BSA 免受热凝胶化时的值大 3 个数量级以上。为了在原子/分子水平解释 SDS 效应,应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80°C 热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。扫频测试表明,没有保护作用的储能模量(G')值比完全保护 BSA 免受热凝胶化时的值大 3 个数量级以上。为了在原子/分子水平解释 SDS 效应,应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80°C 热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。扫频测试表明,没有保护作用的储能模量(G')值比完全保护 BSA 免受热凝胶化时的值大 3 个数量级以上。为了在原子/分子水平解释 SDS 效应,应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80°C 热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子与 BSA 的一些螺旋部分之间的桥接相互作用。应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80 °C 的热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80 °C 的热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。
更新日期:2020-06-01
中文翻译:

流变学和分子动力学模拟研究十二烷基硫酸钠对牛血清白蛋白热变性和凝胶化的保护作用
摘要 众所周知,当水溶液中的牛血清白蛋白 (BSA) 蛋白质被加热到高于蛋白质变性温度(通常 > 65 °C)时,蛋白质会大量展开,并在持续加热下展开的蛋白质聚集形成凝胶。然而,与传统观点相反,我们表明十二烷基硫酸钠 (SDS) 可以在特定浓度范围内保护 BSA 免受热变性和凝胶化,使用 0-1 M SDS 和 3、5 和 7 wt% 的 BSA 浓度。在 80 °C 下通过时间扫描测试研究的 SDS 保护作用随着 SDS 浓度分别增加至 0.85、0.7 和 0.4 M(在 3、5 和 7 wt% BSA 溶液中)而增加。超过这些指定的浓度,SDS 保护作用下降。通过在 80°C 下对纯 BSA 和 BSA/SDS 溶液进行的频率扫描测试进一步证实了保护作用的增加或减少。扫频测试表明,没有保护作用的储能模量(G')值比完全保护 BSA 免受热凝胶化时的值大 3 个数量级以上。为了在原子/分子水平解释 SDS 效应,应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80°C 热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。扫频测试表明,没有保护作用的储能模量(G')值比完全保护 BSA 免受热凝胶化时的值大 3 个数量级以上。为了在原子/分子水平解释 SDS 效应,应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80°C 热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。扫频测试表明,没有保护作用的储能模量(G')值比完全保护 BSA 免受热凝胶化时的值大 3 个数量级以上。为了在原子/分子水平解释 SDS 效应,应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80°C 热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子与 BSA 的一些螺旋部分之间的桥接相互作用。应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80 °C 的热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。应用分子动力学 (MD) 模拟来识别 BSA 的螺旋,这些螺旋在 80 °C 的热变性中受到保护。SDS 保护 BSA 螺旋的分子机制被确立为 SDS 离子和 BSA 的一些螺旋部分之间的桥接相互作用。











































 京公网安备 11010802027423号
京公网安备 11010802027423号