当前位置:
X-MOL 学术
›
BBA Gen. Subj.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural characterization and polymorphism analysis of the NS2B-NS3 protease from the 2017 Brazilian circulating strain of Yellow Fever virus.
Biochimica et Biophysica Acta (BBA) - General Subjects ( IF 2.8 ) Pub Date : 2020-01-10 , DOI: 10.1016/j.bbagen.2020.129521 Gabriela Dias Noske 1 , Victor Oliveira Gawriljuk 1 , Rafaela Sachetto Fernandes 1 , Nathalia Dias Furtado 2 , Myrna Cristina Bonaldo 2 , Glaucius Oliva 1 , Andre Schutzer Godoy 1
Biochimica et Biophysica Acta (BBA) - General Subjects ( IF 2.8 ) Pub Date : 2020-01-10 , DOI: 10.1016/j.bbagen.2020.129521 Gabriela Dias Noske 1 , Victor Oliveira Gawriljuk 1 , Rafaela Sachetto Fernandes 1 , Nathalia Dias Furtado 2 , Myrna Cristina Bonaldo 2 , Glaucius Oliva 1 , Andre Schutzer Godoy 1
Affiliation
|
BACKGROUND
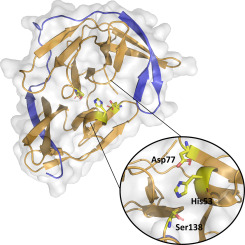
The Yellow Fever virus (YFV) is transmitted by mosquitos and causes an infection with symptoms including fever, headaches and nausea. In 20-50% of the cases, the disease may evolve to a visceral stage, reaching high mortality rates. YFV NS2B-NS3 protease has been identified as an important drug target.
METHODS
Herein, we describe the crystal structure of the NS2B-NS3 protease from the 2017 YFV Brazilian circulating strain using X-ray crystallography. Furthermore, we used a combination of biochemical and biophysical assays to characterize the enzyme and investigate the impact of the polymorphisms observed in different YFV circulating strains.
RESULTS
Surprisingly, the crystal structure of YFV protease seems to adopt the closed conformation without the presence of a binding partner. Although D88E and K121R mutants exhibited a lower affinity for the substrate, both revealed to be more processive, resulting in a similar catalytic efficiency in relation to the WT protease. Still, both mutants showed an accentuated decrease in stability when compared with the WT.
CONCLUSIONS
The crystal structure of YFV NS2B-NS3 in closed conformation might be an important tool for the development of new drugs, as well as understanding the activation mechanism of viral proteases. Biochemical analyses indicate that the NS2B-NS3 protease of the circulating strain of YFV is more stable than previous strains.
GENERAL SIGNIFICANCE
The YFV NS2B-NS3 protease is the first flaviviral structure described in its closed conformation when in a free form, implying that external factors might induce the activation of the enzyme.
中文翻译:

2017年巴西黄热病病毒循环株NS2B-NS3蛋白酶的结构表征和多态性分析。
背景技术黄热病病毒(YFV)由蚊子传播,并引起感染,症状包括发烧,头痛和恶心。在20-50%的病例中,该疾病可能演变为内脏期,达到很高的死亡率。YFV NS2B-NS3蛋白酶已被确定为重要的药物靶标。方法在本文中,我们使用X射线晶体学描述了来自2017 YFV巴西循环菌株的NS2B-NS3蛋白酶的晶体结构。此外,我们结合了生物化学和生物物理分析来表征酶,并研究在不同YFV循环菌株中观察到的多态性的影响。结果出乎意料的是,YFV蛋白酶的晶体结构似乎采用闭合构象,而没有结合伴侣。尽管D88E和K121R突变体对底物表现出较低的亲和力,但两者均显示出更高的合成力,从而导致与WT蛋白酶相似的催化效率。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。两者都显示出更强的合成能力,从而导致与WT蛋白酶相似的催化效率。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。两者都显示出更强的合成力,导致与WT蛋白酶相似的催化效率。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。以及了解病毒蛋白酶的激活机制。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。以及了解病毒蛋白酶的激活机制。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。
更新日期:2020-01-10
中文翻译:

2017年巴西黄热病病毒循环株NS2B-NS3蛋白酶的结构表征和多态性分析。
背景技术黄热病病毒(YFV)由蚊子传播,并引起感染,症状包括发烧,头痛和恶心。在20-50%的病例中,该疾病可能演变为内脏期,达到很高的死亡率。YFV NS2B-NS3蛋白酶已被确定为重要的药物靶标。方法在本文中,我们使用X射线晶体学描述了来自2017 YFV巴西循环菌株的NS2B-NS3蛋白酶的晶体结构。此外,我们结合了生物化学和生物物理分析来表征酶,并研究在不同YFV循环菌株中观察到的多态性的影响。结果出乎意料的是,YFV蛋白酶的晶体结构似乎采用闭合构象,而没有结合伴侣。尽管D88E和K121R突变体对底物表现出较低的亲和力,但两者均显示出更高的合成力,从而导致与WT蛋白酶相似的催化效率。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。两者都显示出更强的合成能力,从而导致与WT蛋白酶相似的催化效率。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。两者都显示出更强的合成力,导致与WT蛋白酶相似的催化效率。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。尽管如此,与WT相比,两个突变体均显示出明显的稳定性下降。结论YFV NS2B-NS3处于封闭构象的晶体结构可能是开发新药以及了解病毒蛋白酶激活机制的重要工具。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。以及了解病毒蛋白酶的激活机制。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。以及了解病毒蛋白酶的激活机制。生化分析表明,YFV循环菌株的NS2B-NS3蛋白酶比以前的菌株更稳定。一般意义YFV NS2B-NS3蛋白酶是以游离形式呈封闭构象形式描述的第一个黄病毒结构,暗示外部因素可能诱导该酶的活化。











































 京公网安备 11010802027423号
京公网安备 11010802027423号