当前位置:
X-MOL 学术
›
STEM CELLS
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Optimizing beta cell function through mesenchymal stromal cell mediated mitochondria transfer
STEM CELLS ( IF 4.0 ) Pub Date : 2020-01-08 , DOI: 10.1002/stem.3134 Chloe L Rackham 1 , Ella L Hubber 1 , Anna Czajka 1 , Afshan N Malik 1 , Aileen J F King 1 , Peter M Jones 1
STEM CELLS ( IF 4.0 ) Pub Date : 2020-01-08 , DOI: 10.1002/stem.3134 Chloe L Rackham 1 , Ella L Hubber 1 , Anna Czajka 1 , Afshan N Malik 1 , Aileen J F King 1 , Peter M Jones 1
Affiliation
|
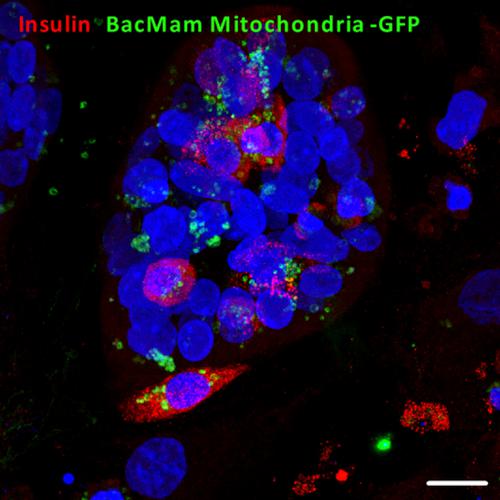
Pretransplant islet culture is associated with the loss of islet cell mass and insulin secretory function. Insulin secretion from islet β‐cells is primarily controlled by mitochondrial ATP generation in response to elevations in extracellular glucose. Coculture of islets with mesenchymal stromal cells (MSCs) improves islet insulin secretory function in vitro, which correlates with superior islet graft function in vivo. This study aimed to determine whether the improved islet function is associated with mitochondrial transfer from MSCs to cocultured islets. We have demonstrated mitochondrial transfer from human adipose MSCs to human islet β‐cells in coculture. Fluorescence imaging showed that mitochondrial transfer occurs, at least partially, through tunneling nanotube (TNT)‐like structures. The extent of mitochondrial transfer to clinically relevant human islets was greater than that to experimental mouse islets. Human islets are subjected to more extreme cellular stressors than mouse islets, which may induce “danger signals” for MSCs, initiating the donation of MSC‐derived mitochondria to human islet β‐cells. Our observations of increased MSC‐mediated mitochondria transfer to hypoxia‐exposed mouse islets are consistent with this and suggest that MSCs are most effective in supporting the secretory function of compromised β‐cells. Ensuring optimal MSC‐derived mitochondria transfer in preculture and/or cotransplantation strategies could be used to maximize the therapeutic efficacy of MSCs, thus enabling the more widespread application of clinical islet transplantation.
中文翻译:

通过间充质基质细胞介导的线粒体转移优化 β 细胞功能
移植前胰岛培养与胰岛细胞团和胰岛素分泌功能的丧失有关。胰岛 β 细胞的胰岛素分泌主要由线粒体 ATP 生成控制,以响应细胞外葡萄糖的升高。胰岛与间充质基质细胞 (MSC) 的共培养可改善体外胰岛胰岛素分泌功能,这与体内胰岛移植物的优良功能相关。本研究旨在确定改善的胰岛功能是否与从 MSCs 到共培养胰岛的线粒体转移有关。我们已经证明了在共培养中线粒体从人脂肪 MSC 转移到人胰岛 β 细胞。荧光成像表明,线粒体转移至少部分是通过隧道纳米管(TNT)样结构发生的。线粒体转移到临床相关的人类胰岛的程度大于实验小鼠胰岛的程度。与小鼠胰岛相比,人类胰岛会受到更极端的细胞压力,这可能会引发 MSC 的“危险信号”,从而启动 MSC 衍生的线粒体向人类胰岛 β 细胞的捐赠。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。与小鼠胰岛相比,人类胰岛会受到更极端的细胞压力,这可能会引发 MSC 的“危险信号”,从而启动 MSC 衍生的线粒体向人类胰岛 β 细胞的捐赠。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。与小鼠胰岛相比,人类胰岛会受到更极端的细胞压力,这可能会引发 MSC 的“危险信号”,从而启动 MSC 衍生的线粒体向人类胰岛 β 细胞的捐赠。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。开始将 MSC 衍生的线粒体捐赠给人类胰岛 β 细胞。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。开始将 MSC 衍生的线粒体捐赠给人类胰岛 β 细胞。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。
更新日期:2020-01-08
中文翻译:

通过间充质基质细胞介导的线粒体转移优化 β 细胞功能
移植前胰岛培养与胰岛细胞团和胰岛素分泌功能的丧失有关。胰岛 β 细胞的胰岛素分泌主要由线粒体 ATP 生成控制,以响应细胞外葡萄糖的升高。胰岛与间充质基质细胞 (MSC) 的共培养可改善体外胰岛胰岛素分泌功能,这与体内胰岛移植物的优良功能相关。本研究旨在确定改善的胰岛功能是否与从 MSCs 到共培养胰岛的线粒体转移有关。我们已经证明了在共培养中线粒体从人脂肪 MSC 转移到人胰岛 β 细胞。荧光成像表明,线粒体转移至少部分是通过隧道纳米管(TNT)样结构发生的。线粒体转移到临床相关的人类胰岛的程度大于实验小鼠胰岛的程度。与小鼠胰岛相比,人类胰岛会受到更极端的细胞压力,这可能会引发 MSC 的“危险信号”,从而启动 MSC 衍生的线粒体向人类胰岛 β 细胞的捐赠。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。与小鼠胰岛相比,人类胰岛会受到更极端的细胞压力,这可能会引发 MSC 的“危险信号”,从而启动 MSC 衍生的线粒体向人类胰岛 β 细胞的捐赠。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。与小鼠胰岛相比,人类胰岛会受到更极端的细胞压力,这可能会引发 MSC 的“危险信号”,从而启动 MSC 衍生的线粒体向人类胰岛 β 细胞的捐赠。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。开始将 MSC 衍生的线粒体捐赠给人类胰岛 β 细胞。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。开始将 MSC 衍生的线粒体捐赠给人类胰岛 β 细胞。我们对 MSC 介导的线粒体转移到缺氧暴露的小鼠胰岛的观察结果与此一致,并表明 MSC 在支持受损 β 细胞的分泌功能方面最有效。在预培养和/或联合移植策略中确保最佳的 MSC 衍生线粒体转移可用于最大限度地提高 MSC 的治疗效果,从而使临床胰岛移植得到更广泛的应用。











































 京公网安备 11010802027423号
京公网安备 11010802027423号