当前位置:
X-MOL 学术
›
Oncogenesis
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
DDIAS promotes STAT3 activation by preventing STAT3 recruitment to PTPRM in lung cancer cells.
Oncogenesis ( IF 5.9 ) Pub Date : 2020-01-02 , DOI: 10.1038/s41389-019-0187-2 Joo-Young Im 1 , Bo-Kyung Kim 1 , Kang-Woo Lee 2 , So-Young Chun 1 , Mi-Jung Kang 1 , Misun Won 1, 3
Oncogenesis ( IF 5.9 ) Pub Date : 2020-01-02 , DOI: 10.1038/s41389-019-0187-2 Joo-Young Im 1 , Bo-Kyung Kim 1 , Kang-Woo Lee 2 , So-Young Chun 1 , Mi-Jung Kang 1 , Misun Won 1, 3
Affiliation
|
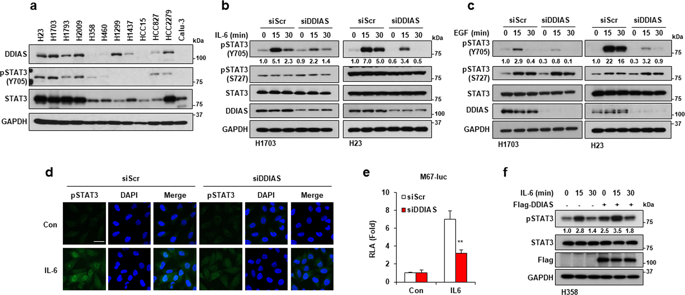
DNA damage-induced apoptosis suppressor (DDIAS) regulates cancer cell survival. Here we investigated the involvement of DDIAS in IL-6-mediated signaling to understand the mechanism underlying the role of DDIAS in lung cancer malignancy. We showed that DDIAS promotes tyrosine phosphorylation of signal transducer and activator of transcription 3 (STAT3), which is constitutively activated in malignant cancers. Interestingly, siRNA protein tyrosine phosphatase (PTP) library screening revealed protein tyrosine phosphatase receptor mu (PTPRM) as a novel STAT3 PTP. PTPRM knockdown rescued the DDIAS-knockdown-mediated decrease in STAT3 Y705 phosphorylation in the presence of IL-6. However, PTPRM overexpression decreased STAT3 Y705 phosphorylation. Moreover, endogenous PTPRM interacted with endogenous STAT3 for dephosphorylation at Y705 following IL-6 treatment. As expected, PTPRM bound to wild-type STAT3 but not the STAT3 Y705F mutant. PTPRM dephosphorylated STAT3 in the absence of DDIAS, suggesting that DDIAS hampers PTPRM/STAT3 interaction. In fact, DDIAS bound to the STAT3 transactivation domain (TAD), which competes with PTPRM to recruit STAT3 for dephosphorylation. Thus we show that DDIAS prevents PTPRM/STAT3 binding and blocks STAT3 Y705 dephosphorylation, thereby sustaining STAT3 activation in lung cancer. DDIAS expression strongly correlates with STAT3 phosphorylation in human lung cancer cell lines and tissues. Thus DDIAS may be considered as a potential biomarker and therapeutic target in malignant lung cancer cells with aberrant STAT3 activation.
中文翻译:

DDIAS通过阻止STAT3募集到PTPRM肺癌细胞中来促进STAT3激活。
DNA损伤诱导的凋亡抑制因子(DDIAS)调节癌细胞的存活。在这里,我们调查了DDIAS在IL-6介导的信号传导中的参与,以了解DDIAS在肺癌恶性肿瘤中的作用机理。我们发现,DDIAS促进信号转导子和转录激活因子3(STAT3)的酪氨酸磷酸化,后者在恶性肿瘤中被组成性激活。有趣的是,siRNA蛋白酪氨酸磷酸酶(PTP)库筛选揭示了蛋白酪氨酸磷酸酶受体μ(PTPRM)作为一种新型STAT3 PTP。PTPRM敲低挽救了在IL-6存在下DDIAS敲低介导的STAT3 Y705磷酸化水平的降低。然而,PTPRM过表达降低了STAT3 Y705的磷酸化。此外,IL-6处理后,内源性PTPRM与内源性STAT3相互作用以在Y705处进行去磷酸化。如预期的那样,PTPRM与野生型STAT3结合,但不与STAT3 Y705F突变体结合。在没有DDIAS的情况下PTPRM使STAT3去磷酸化,表明DDIAS阻碍了PTPRM / STAT3的相互作用。实际上,DDIAS绑定到STAT3反激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。PTPRM绑定到野生型STAT3,但不是STAT3 Y705F突变体。在没有DDIAS的情况下PTPRM使STAT3磷酸化,这表明DDIAS阻碍了PTPRM / STAT3的相互作用。实际上,DDIAS绑定到STAT3反激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。PTPRM绑定到野生型STAT3,但不是STAT3 Y705F突变体。在没有DDIAS的情况下PTPRM使STAT3去磷酸化,表明DDIAS阻碍了PTPRM / STAT3的相互作用。实际上,DDIAS绑定到STAT3反激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。DDIAS绑定到STAT3反式激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。DDIAS绑定到STAT3反式激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞的潜在生物标志物和治疗靶标。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。
更新日期:2020-01-02
中文翻译:

DDIAS通过阻止STAT3募集到PTPRM肺癌细胞中来促进STAT3激活。
DNA损伤诱导的凋亡抑制因子(DDIAS)调节癌细胞的存活。在这里,我们调查了DDIAS在IL-6介导的信号传导中的参与,以了解DDIAS在肺癌恶性肿瘤中的作用机理。我们发现,DDIAS促进信号转导子和转录激活因子3(STAT3)的酪氨酸磷酸化,后者在恶性肿瘤中被组成性激活。有趣的是,siRNA蛋白酪氨酸磷酸酶(PTP)库筛选揭示了蛋白酪氨酸磷酸酶受体μ(PTPRM)作为一种新型STAT3 PTP。PTPRM敲低挽救了在IL-6存在下DDIAS敲低介导的STAT3 Y705磷酸化水平的降低。然而,PTPRM过表达降低了STAT3 Y705的磷酸化。此外,IL-6处理后,内源性PTPRM与内源性STAT3相互作用以在Y705处进行去磷酸化。如预期的那样,PTPRM与野生型STAT3结合,但不与STAT3 Y705F突变体结合。在没有DDIAS的情况下PTPRM使STAT3去磷酸化,表明DDIAS阻碍了PTPRM / STAT3的相互作用。实际上,DDIAS绑定到STAT3反激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。PTPRM绑定到野生型STAT3,但不是STAT3 Y705F突变体。在没有DDIAS的情况下PTPRM使STAT3磷酸化,这表明DDIAS阻碍了PTPRM / STAT3的相互作用。实际上,DDIAS绑定到STAT3反激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。PTPRM绑定到野生型STAT3,但不是STAT3 Y705F突变体。在没有DDIAS的情况下PTPRM使STAT3去磷酸化,表明DDIAS阻碍了PTPRM / STAT3的相互作用。实际上,DDIAS绑定到STAT3反激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。DDIAS绑定到STAT3反式激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。DDIAS绑定到STAT3反式激活域(TAD),后者与PTPRM竞争以招募STAT3进行去磷酸化。因此,我们表明DDIAS可以防止PTPRM / STAT3结合并阻止STAT3 Y705去磷酸化,从而在肺癌中维持STAT3活化。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞的潜在生物标志物和治疗靶标。DDIAS表达与人肺癌细胞系和组织中的STAT3磷酸化密切相关。因此,DDIAS可被认为是STAT3激活异常的恶性肺癌细胞中潜在的生物标志物和治疗靶标。











































 京公网安备 11010802027423号
京公网安备 11010802027423号