Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Phage-specific metabolic reprogramming of virocells.
The ISME Journal ( IF 10.8 ) Pub Date : 2020-01-02 , DOI: 10.1038/s41396-019-0580-z Cristina Howard-Varona 1 , Morgan M Lindback 2 , G Eric Bastien 2 , Natalie Solonenko 1 , Ahmed A Zayed 1 , HoBin Jang 1 , Bill Andreopoulos 3 , Heather M Brewer 4 , Tijana Glavina Del Rio 3 , Joshua N Adkins 5 , Subhadeep Paul 6 , Matthew B Sullivan 1, 7, 8 , Melissa B Duhaime 2
The ISME Journal ( IF 10.8 ) Pub Date : 2020-01-02 , DOI: 10.1038/s41396-019-0580-z Cristina Howard-Varona 1 , Morgan M Lindback 2 , G Eric Bastien 2 , Natalie Solonenko 1 , Ahmed A Zayed 1 , HoBin Jang 1 , Bill Andreopoulos 3 , Heather M Brewer 4 , Tijana Glavina Del Rio 3 , Joshua N Adkins 5 , Subhadeep Paul 6 , Matthew B Sullivan 1, 7, 8 , Melissa B Duhaime 2
Affiliation
|
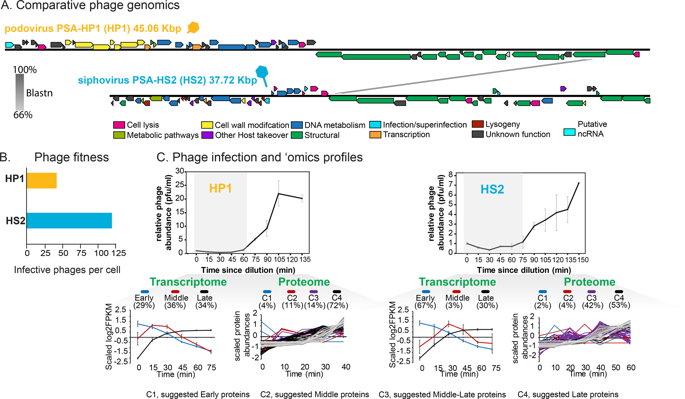
Ocean viruses are abundant and infect 20-40% of surface microbes. Infected cells, termed virocells, are thus a predominant microbial state. Yet, virocells and their ecosystem impacts are understudied, thus precluding their incorporation into ecosystem models. Here we investigated how unrelated bacterial viruses (phages) reprogram one host into contrasting virocells with different potential ecosystem footprints. We independently infected the marine Pseudoalteromonas bacterium with siphovirus PSA-HS2 and podovirus PSA-HP1. Time-resolved multi-omics unveiled drastically different metabolic reprogramming and resource requirements by each virocell, which were related to phage-host genomic complementarity and viral fitness. Namely, HS2 was more complementary to the host in nucleotides and amino acids, and fitter during infection than HP1. Functionally, HS2 virocells hardly differed from uninfected cells, with minimal host metabolism impacts. HS2 virocells repressed energy-consuming metabolisms, including motility and translation. Contrastingly, HP1 virocells substantially differed from uninfected cells. They repressed host transcription, responded to infection continuously, and drastically reprogrammed resource acquisition, central carbon and energy metabolisms. Ecologically, this work suggests that one cell, infected versus uninfected, can have immensely different metabolisms that affect the ecosystem differently. Finally, we relate phage-host genome complementarity, virocell metabolic reprogramming, and viral fitness in a conceptual model to guide incorporating viruses into ecosystem models.
中文翻译:

噬菌体的噬菌体特异性代谢重编程。
海洋病毒丰富,可感染20-40%的表面微生物。因此,被称为病毒细胞的感染细胞是主要的微生物状态。然而,病毒细胞及其对生态系统的影响尚未得到充分研究,因此排除了将其纳入生态系统模型的可能性。在这里,我们研究了无关的细菌病毒(噬菌体)如何将一台宿主重编程为具有不同潜在生态系统足迹的对比病毒细胞。我们用siphovirus PSA-HS2和足病毒PSA-HP1独立感染了海洋假单胞菌细菌。时间分辨的多组学揭示了每个病毒细胞完全不同的代谢重编程和资源需求,这与噬菌体宿主基因组的互补性和病毒适应性有关。即,与HP1相比,HS2在核苷酸和氨基酸上与宿主更互补,并且在感染期间更适合。在功能上 HS2病毒细胞与未感染的细胞几乎没有区别,宿主代谢影响最小。HS2 virocells抑制了包括运动和翻译在内的能量消耗代谢。相反,HP1病毒细胞与未感染的细胞有很大的不同。他们抑制宿主转录,对感染持续作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。HS2 virocells抑制了包括运动和翻译在内的能量消耗代谢。相反,HP1病毒细胞与未感染的细胞有很大的不同。他们抑制宿主转录,对感染持续作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。HS2 virocells抑制了包括运动和翻译在内的能量消耗代谢。相反,HP1病毒细胞与未感染的细胞有很大的不同。他们抑制宿主转录,对感染持续做出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明,一个细胞(受感染和未受感染)可以具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。持续对感染作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。持续对感染作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。
更新日期:2020-01-17
中文翻译:

噬菌体的噬菌体特异性代谢重编程。
海洋病毒丰富,可感染20-40%的表面微生物。因此,被称为病毒细胞的感染细胞是主要的微生物状态。然而,病毒细胞及其对生态系统的影响尚未得到充分研究,因此排除了将其纳入生态系统模型的可能性。在这里,我们研究了无关的细菌病毒(噬菌体)如何将一台宿主重编程为具有不同潜在生态系统足迹的对比病毒细胞。我们用siphovirus PSA-HS2和足病毒PSA-HP1独立感染了海洋假单胞菌细菌。时间分辨的多组学揭示了每个病毒细胞完全不同的代谢重编程和资源需求,这与噬菌体宿主基因组的互补性和病毒适应性有关。即,与HP1相比,HS2在核苷酸和氨基酸上与宿主更互补,并且在感染期间更适合。在功能上 HS2病毒细胞与未感染的细胞几乎没有区别,宿主代谢影响最小。HS2 virocells抑制了包括运动和翻译在内的能量消耗代谢。相反,HP1病毒细胞与未感染的细胞有很大的不同。他们抑制宿主转录,对感染持续作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。HS2 virocells抑制了包括运动和翻译在内的能量消耗代谢。相反,HP1病毒细胞与未感染的细胞有很大的不同。他们抑制宿主转录,对感染持续作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。HS2 virocells抑制了包括运动和翻译在内的能量消耗代谢。相反,HP1病毒细胞与未感染的细胞有很大的不同。他们抑制宿主转录,对感染持续做出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明,一个细胞(受感染和未受感染)可以具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。持续对感染作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。持续对感染作出反应,并对资源获取,中心碳和能量代谢进行了重新编程。从生态上讲,这项工作表明一个细胞,无论受感染还是未受感染,都可能具有极为不同的新陈代谢,从而对生态系统产生不同的影响。最后,我们在概念模型中关联噬菌体-宿主基因组的互补性,病毒细胞代谢重编程和病毒适应性,以指导将病毒整合到生态系统模型中。











































 京公网安备 11010802027423号
京公网安备 11010802027423号