Nat. Chem.:光催化,醇与烯烃的直接双官能团化
1,2-二醇和1,2-氨基醇是药物分子(如:拉平他乐和达格列净)、天然产物(如:紫杉醇和肾上腺素)和农用化学品(如:异丙甲草胺)中极为常见的骨架(图1a),正因如此,化学家们也一直在探索合成它们的新方法。理想情况下,通过两类简单易得原料(即烯烃与醇或其它含杂原子亲核试剂)的直接加成就可在烯烃C=C双键上安装两个杂原子基团,但由于醇和烯烃都富电子,只有当其中一种反应物通过衍生化变得缺电子时(如:将烯烃衍生化为环氧化物/卤鎓离子)才有可能直接进行加成。这些方法通常需要使用化学计量强氧化剂,因此底物兼容性差且反应步骤繁琐(图1b)。近年来,光催化策略为化学家提供了一种更简便的方法(图 1c),可以从一系列稳定的前体中生成烷氧基自由基。但对于烯烃双官能团化反应,烷氧基自由基通常并非由醇制备,而是由烷基(伪)卤化物在多步合成中通过亲核取代产生的,因此它们受到SN2或SN1反应所要求的有限结构变化的影响。此外,一种更方便的方法是直接利用醇原料,这些原料在烯烃加成之前通过光催化质子耦合电子转移原位转化为相应的烷氧基自由基,但是这种方法需要将碱与氧化性光催化剂结合使用。
近日,英国曼彻斯特大学的David J. Procter教授课题组基于Pummerer型反应使用亚砜活化底物,在光催化条件下将简单和复杂醇转化为相应的烷氧基自由基(通过形成烷氧基锍盐前体获得),再与烯烃进行反应便可生成一系列1,2-二醇和1,2-氨基醇衍生物(图1d)。值得一提的是,使用光流动体系,该方法可以很容易地从实验室毫克级规模放大至工业公斤级规模。相关成果发表在Nature Chemistry 上。
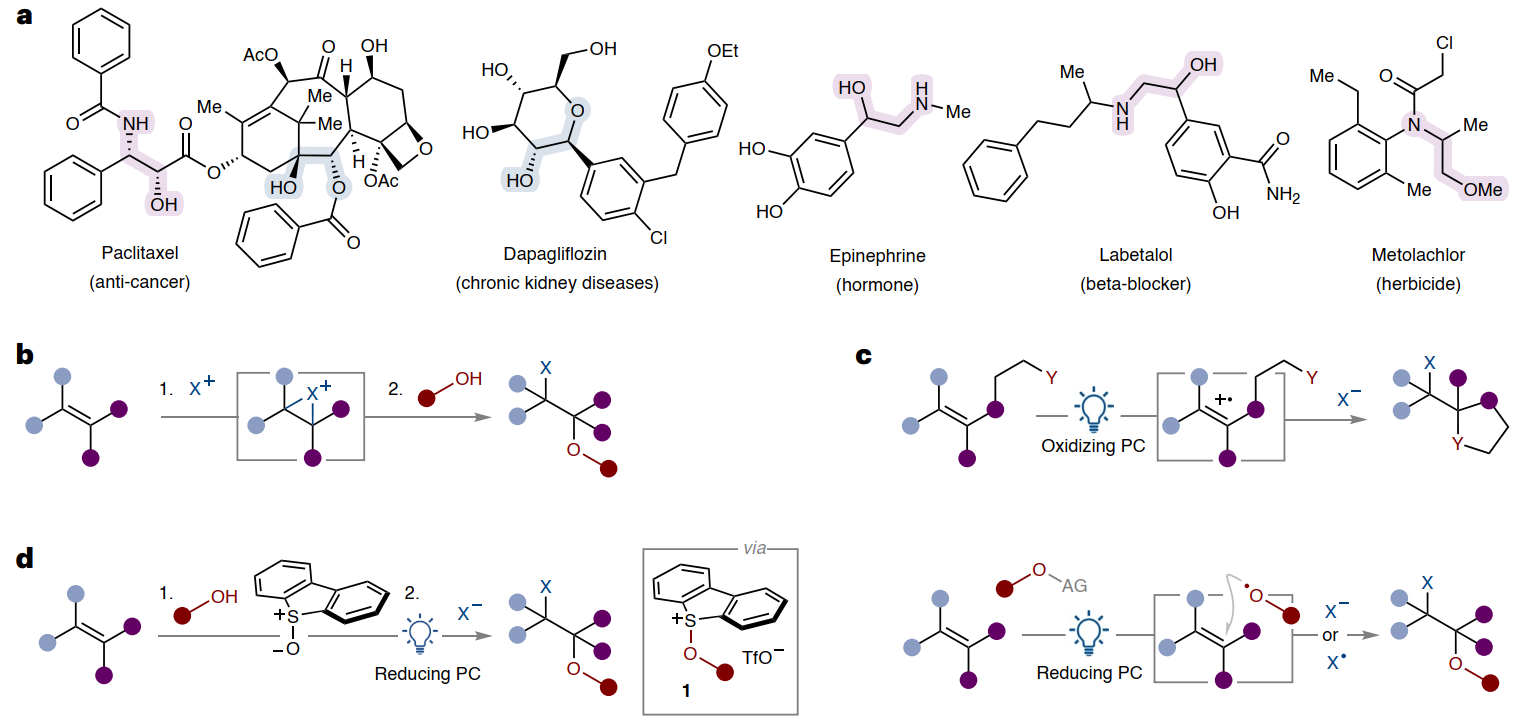
图1. 1,2-二醇和1,2-氨基醇结构单元及其构建方法。图片来源:Nat. Chem.
首先,作者选择甲醇和市售二苯并噻吩S-氧化物2为模板底物来制备烷氧基锍盐1a,该化合物易分离和表征且能进行大规模合成(产率:86%,3.15 g);同时1a能在工业环境中以1 kg规模进行制备。如图2所示,一系列伯醇和仲醇衍生的烷氧基锍盐(1a-1ah)均能以高产率制备而成,同时没有观察到醇氧化产物,尽管只有少数叔醇可以参与该反应(如:1ai)。此外,该反应还能耐受多种官能团,例如:卤化物(1d、1e、1i、1j、1o、1y、1z、1ad)、氰基(1k)、酯基(1s、1x、1aa、1ab)、砜(1l)、烯烃(1m)、炔烃(1n、1o、1u)、叔醇(1q)、丙烯酸酯(1r)和邻苯二甲酰亚胺(1p、1s),同时还能耐受对映纯醇底物(如:1aa、1ab、1s、1t)。
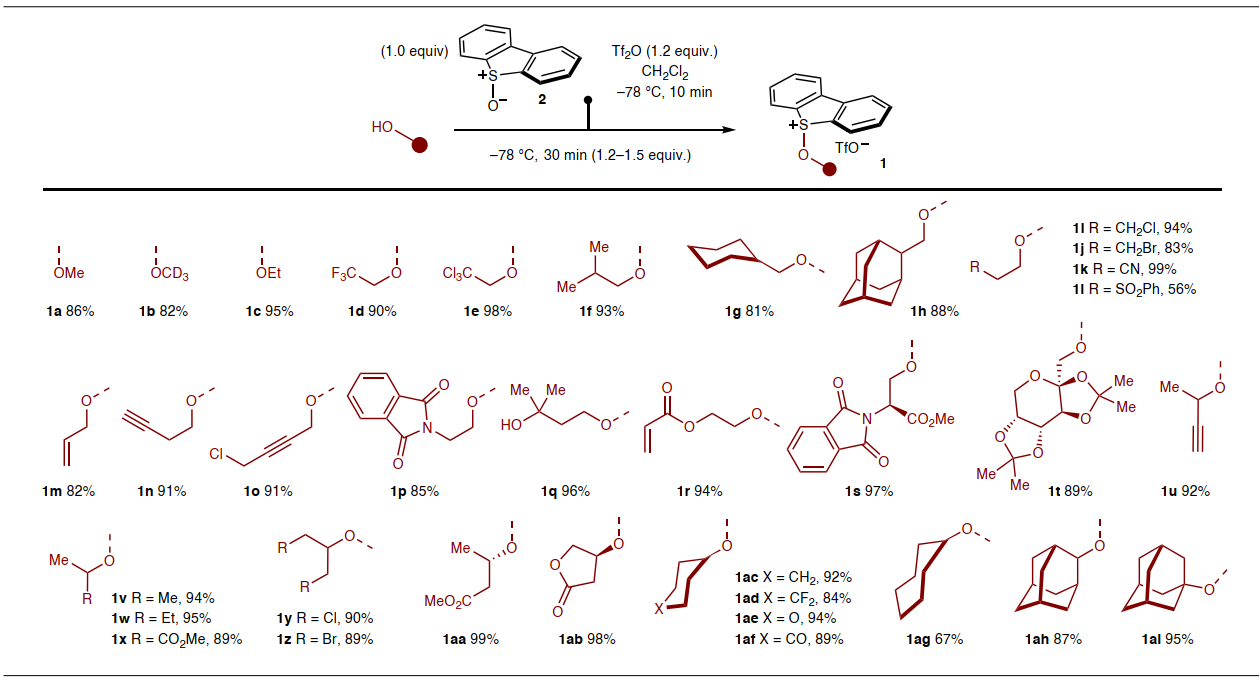
图2. 由醇制备的烷氧基锍盐。图片来源:Nat. Chem.
随后,作者选择烷氧基锍盐1a和4-氯苯乙烯3a为模板底物对光催化烯烃的异双官能团化反应条件进行优化(图3),并得到最佳反应条件:即1a和3a在光催化剂PC1(0.1 mol%)、Na2HPO4(50 mol%)、H2O(2.0 equiv)和丙酮的存在下用456 nm LEDs照射3 h,能以83%的产率获得所需产物4a。此外,通过降低反应温度并使用光催化剂可以减少2(可能通过1a的水解形成)和2′(通过1a的直接均裂形成)的生成;而在较高反应温度下,在更多烷氧基锍盐的存在下观察到由4a氧化产生的芳基酮副产物,这可能是4a的苄基位置被烷氧基自由基取代。在优化条件下,只观察到微量的芳基酮副产物。值得一提的是,对照实验表明光照、光催化剂和丙酮对该反应至关重要,而对温度、碱和H2O的存在略微敏感。
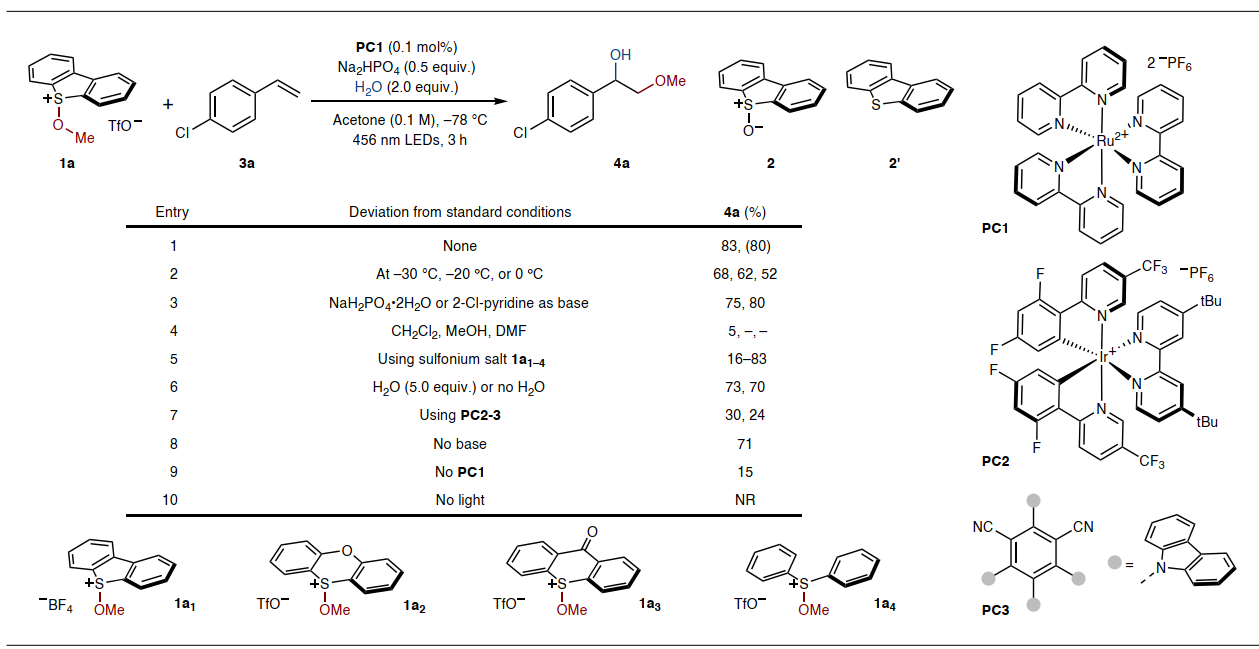
图3. 烯烃1,2-烷氧基羟基化反应的优化。图片来源:Nat. Chem.
在最优条件下,作者考察了烯烃的底物范围(图4),结果显示对位(4a-4m、4z和4aa-4ac)、间位(4n-4t)和邻位(4u-4y)带有吸/供电子基团的苯乙烯衍生物、多取代苯乙烯衍生物(4ad-4ai)、1-乙烯基萘(4aj)、2-乙烯基萘(4ak)、杂芳基取代的烯烃(4al-4aq)甚至多取代烯烃(4ar-4be)均能兼容该反应,以中等至较好的产率获得相应产物,而且作者还通过X-射线衍射分析证实了4be的结构。总之,该方法能够耐受多种取代模式和官能团,凸显了其广泛的适用性。然而,该方法目前仅适用于苯乙烯类烯烃,当使用烷基取代的烯烃时,未观察到产物生成。
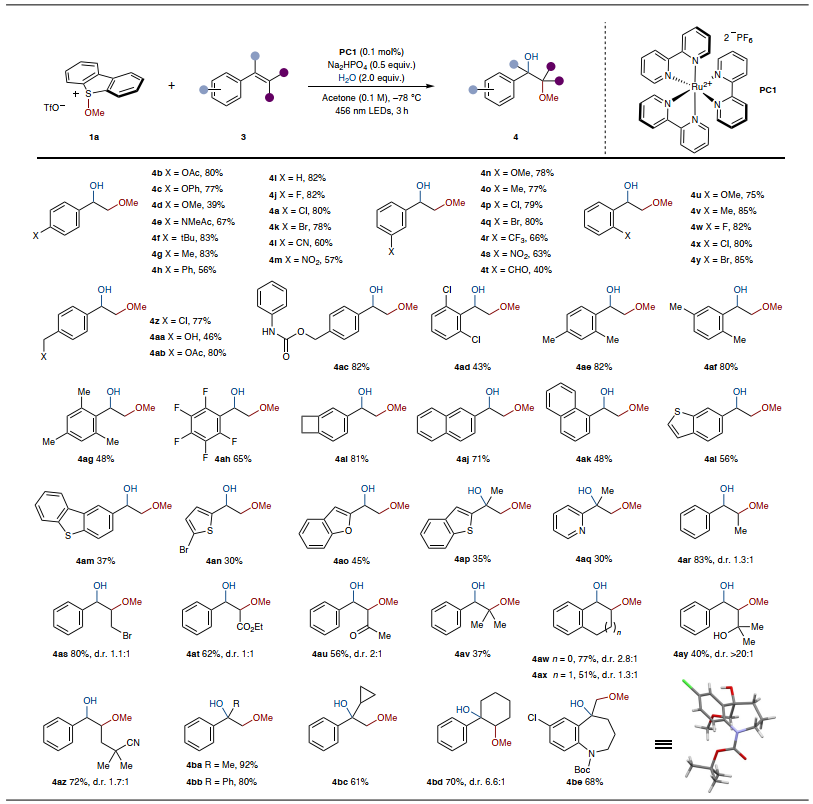
图4. 底物范围。图片来源:Nat. Chem.
接下来,作者探索了烷氧基锍盐的底物适用性(图5a),结果显示氘代甲醇(4bf)、乙醇(4bg)、β-官能团化的伯醇衍生物(4bh-4bx)甚至仲醇(4by-4cl)和叔醇(4cm)衍生物均能顺利进行烯烃双官能团化反应,以中等至良好的产率获得相应产物。此外,该反应还能耐受多种官能团,例如:伯卤化物(4bn、4bo、4bu、4cc、4cd)、氰基(4bm)、砜(4bp)、邻苯二甲酰亚胺(4bq和受保护氨基酸4bx)、羟基(4br)、酮羰基(4cj)、α,β-不饱和酯(4bs)、烯烃(4bt)、炔烃(4bu、4bv、4cb)、酯基(4bx、4ca、4ce)、内酯(4cf)和缩酮(4bw)。其次,对反应条件稍加修改后,作者成功实现了烯烃的二烷氧基化反应,而先前由二醇合成不对称1,2-二醚(两个氧原子上有不同的烷基)却通常需要高效有毒的烷基化试剂。如图5b所示,烯烃3a、甲氧基锍盐1a和一系列醇亲核试剂能够有效地进行反应,如:甲醇(5a)、溴乙醇(5b)、2-(三甲基甲硅烷基)乙醇(5c)、2-甲氧基乙醇(5d)、苯甲醇(5e)、受保护的丝氨酸(5f)、环丁醇(5g)、叔丁醇(5h),从而以中等至良好的产率获得相应的1,2-二醚。类似地,使用廉价的腈作为共溶剂实现了烯烃3a的1,2-烷氧基酰胺化,并以中等产率分离出酰胺(6a-6h)和痕量的1,2-烷氧基羟基化产物;而使用苯甲腈作为共溶剂时,从肉桂酸乙酯制备了紫杉醇侧链的类似物6i。
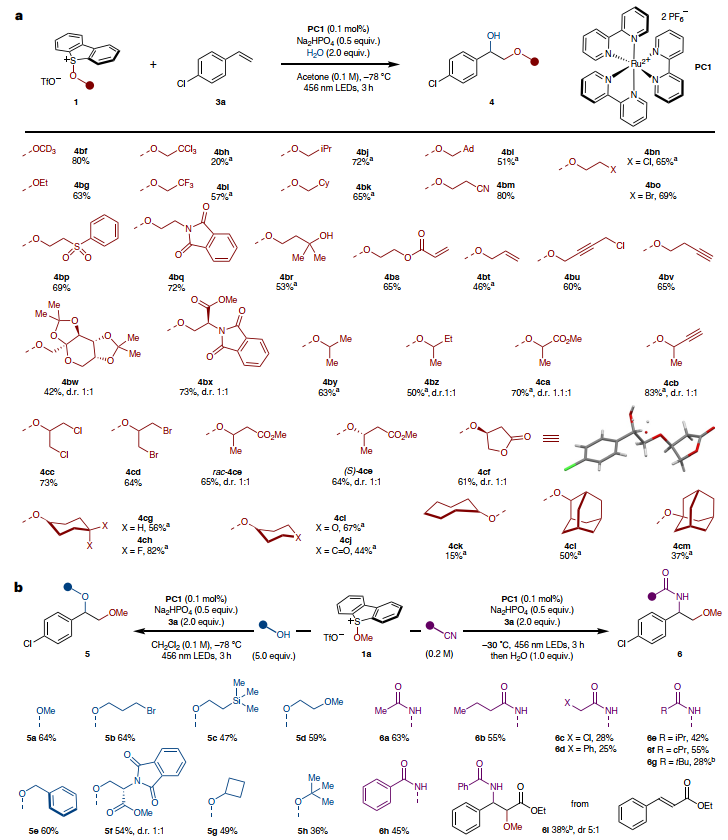
图5. 烷氧基锍盐在烯烃光催化双官能化反应中的应用。图片来源:Nat. Chem.
如图6a所示,作者选择甲氧基锍盐1a和苯乙烯3a为模板底物开发了一个双进料光流动化学体系,即将1a与丙酮、苯乙烯3a与光催化剂、有机碱、水的两种等体积溶液以相同的流速混合并冷却至0 °C,同时发现5分钟的停留时间足以实现良好的转化率和优异的产率。基于此,作者将反应放大至千克级规模光流反应器,从1.0 kg 1a出发,以64%的产率获得4a。随后,作者提出了可能的反应机理(图6b):首先,光激发PC1在蓝光照射下引发烷氧基锍盐1的单电子转移(SET)还原并产生高活性的烷氧基自由基I,I与烯烃进行加成反应并产生苄基自由基II,其被PC1+氧化为相应的碳正离子III,从而关闭光催化循环(path a)。然后,碳正离子中间体III被亲核试剂(如:水、醇或腈)进攻便可得到烯烃1,2-双官能团化产物4-6。为了探索提出的反应机理,作者进行了一系列实验,具体而言:1)Stern-Volmer荧光淬灭研究表明烷氧基锍盐(如:1a)是PC1激发态的唯一淬灭剂(图6c),进而支持反应第一步中盐的SET还原;2)对1a的循环伏安法研究发现其还原电位比PC1激发态更正(图6d),进一步支持了所提出的SET过程;3)向标准反应条件下加入自由基清除剂2,2,6,6-四甲基哌啶氧化物后(图6e),高分辨率质谱(HR-MS)检测到自由基中间体II拦截的2,2,6,6-四甲基哌啶-1-氧基加合物7,进而证实了烷氧基自由基I与烯烃的加成;4)当带有β-支链烷氧基的锍盐1aj与4-甲基喹啉8在标准条件下进行反应时得到了Minisci型偶联产物9和由烷氧基自由基物种β-裂解形成的自由基产生的醛10a、10b(图6f),进而支持了烷氧基自由基的参与;5)HR-MS还检测到由III与催化循环早期释放的二苯并噻吩2′反应形成的锍盐IV,进而证实了苄基碳正离子III的存在;6)1a和3a偶联得到4a的量子产率(ø)为1.02,这表明至少部分参与了自由基链机制,其中II还原了起始烷氧基锍盐1a(图6b,path b)。
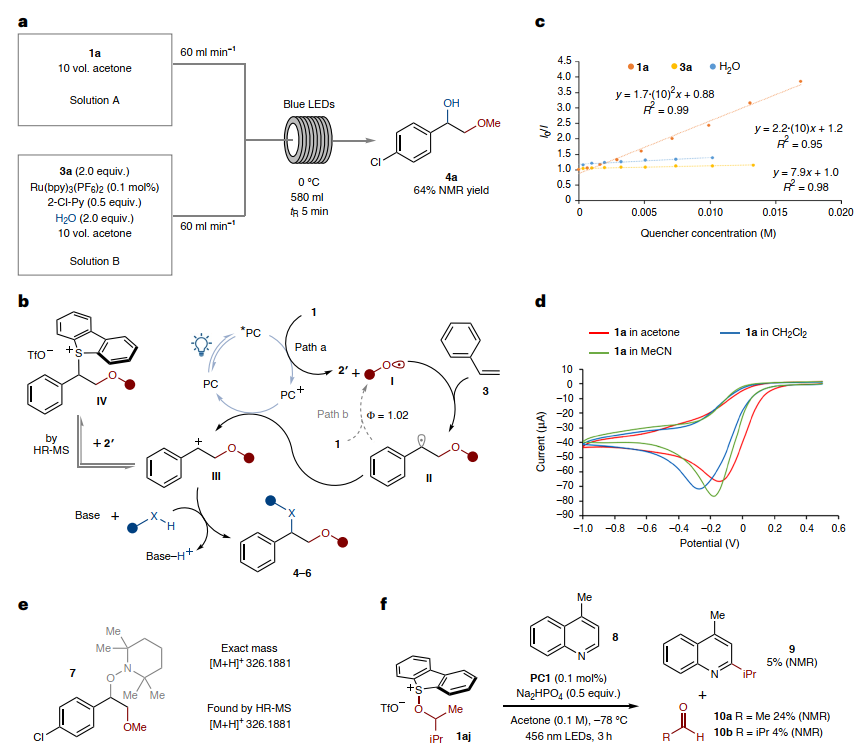
图6. 放大反应及机理研究。图片来源:Nat. Chem.
总结
David J. Procter教授课题组报道了一种简便的方法,可在光催化条件下将简单和复杂的醇转化为相应的烷氧基自由基(通过生成烷氧基锍盐),这些烷氧基自由基与烯烃进行反应便可生成1,2-二醇和1,2-氨基醇衍生物。该方法可利用光流动系统轻松地从实验室规模放大到工业公斤级规模。机理研究表明该光催化循环涉及烷氧基锍盐的还原并生成烷氧基自由基,该自由基与烯烃发生分子间加成反应。随后,碳中心自由基加合物的氧化可再生光催化剂,从而完成催化循环。通过烷氧基锍盐的形成来简便地活化醇类化合物以用于光化学反应,将有助于未来化学合成的发展。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Activation of alcohols as sulfonium salts in the photocatalytic hetero-difunctionalization of alkenes
Huaibo Zhao, Dario Filippini, Yiding Chen, Albert Gallego-Gamo, Louise S. Natrajan, Loïc R. E. Pantaine, Ciro Romano, David J. Procter
Nat. Chem., 2025, DOI: 10.1038/s41557-025-02003-7
导师介绍
David J. Procter
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
























































 京公网安备 11010802027423号
京公网安备 11010802027423号