Science:合成三氟甲基-杂原子阴离子的“流水线”
含三氟甲基(CF3)的化合物在药物化学、农用化学品、功能材料等领域发挥着重要作用,以美国食品和药物管理局(FDA)批准上市的药物为例,所有药物中约有5%含有CF3。究其原因,氟原子的吸电子性质会诱导邻近基团的强烈极化,增加局部疏水性,而且氟化官能团还能提高化合物的代谢稳定性,从而提高其生物活性。在过去的几十年里,如何向有机分子中引入三氟甲基一直受到化学家的广泛关注,已经发展了多种方法来构建C-CF3键。近年来,化学家对与杂原子结合的三氟甲基(如:三氟甲氧基(OCF3)、三氟甲硫基(SCF3)和N-三氟甲基(NCF3))的兴趣日益浓厚(图1A),这是因为它们可进一步调节分子的亲脂性、抗氧化性和酸碱性。然而,这些基团在活性药物成分(APIs)中的占比极低,仅占含CF3药物总量的不到10%,这主要是由于其可用的合成方法十分有限,并且通常需要使用昂贵、对湿度敏感且原子效率低的试剂(图1B),此外这些试剂的合成过程很繁琐,会产生大量氟化废物。
近日,荷兰阿姆斯特丹大学Timothy Noël教授课题组利用流动化学策略,以氟化铯作为唯一氟源,将市售可得/易制备且稳定的有机前体按需转化为极具反应性的NCF3(R)、SCF3和OCF3阴离子片段(图1C),它们可作为亲核试剂参与后续转化。值得一提的是,该反应是通过两个连续的氯-氟交换反应和氟化物加成将这些前体顺序转化为所需的含三氟甲基亲核试剂,与合适的亲电试剂进行反应便可形成新的C-N、C-S或C-O键。相关成果发表在Science 上。
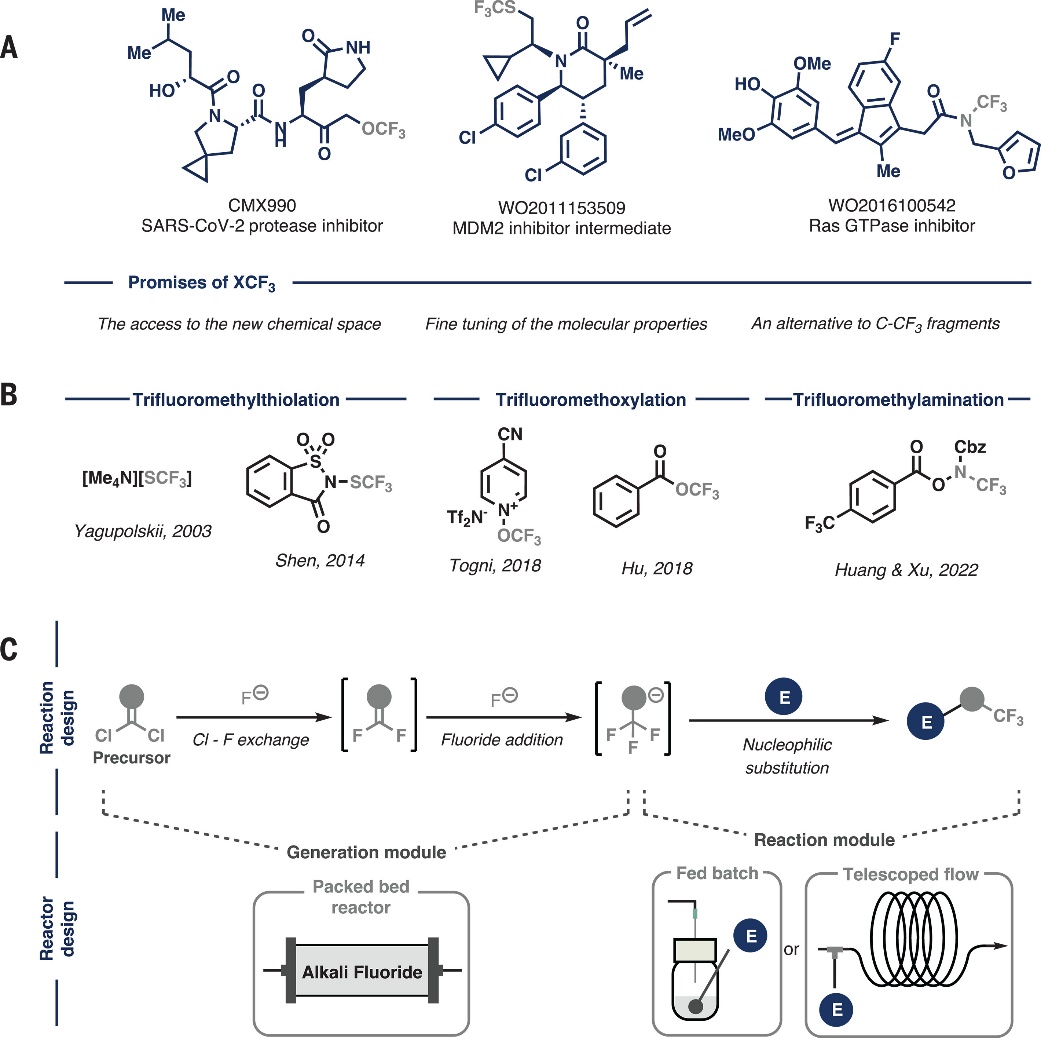
图1. 研究概述。图片来源:Science
首先,作者选择受保护的酰亚胺二氯化物(1-3)作为前体并通过其与氟源的反应来生成NCF3(PG)阴离子(图2),通过三个连续的C-F键形成来获得亲核物种。需要指出的是,这些前体可以从廉价易得的起始原料出发以克级规模进行制备(如:Ts 1 >30 g、Cbz 2 >4 g、Boc 3 7 g),而且15N 标记的酰亚胺二氯化物也可以轻松合成[(15N)Ts 1 >3 g]。此外,试剂1是固体、试剂2和3是液体,同时差示扫描量热法(DSC)和热重分析(TGA)显示试剂1的热稳定性良好并且在>180 ℃时才会分解。其次,将Ts保护的酰亚胺二氯化物1与9 equiv CsF在乙腈中混合反应2 h后,19F NMR检测到三氟甲基氨基阴离子物种,随后向反应混合物中加入苄基溴并在80 ℃反应2 h后能以63%的产率得到N-三氟甲基苄胺4。另一方面,作者尝试使用流动化学策略来实现这一转化,但是该策略的一个关键是氮原子上的电子密度,当氮原子上的电子密度较大时,三氟甲基氨基阴离子易发生α-脱氟反应。为了减轻这种分解途径同时保持最佳亲核性,作者将18-冠醚-6与前体结合使用以使铯阳离子络合,进而阻止其与氟原子相互作用并稳定所需的阴离子物种。事实上,将1和18-冠醚-6(1 equiv)的溶液流过填充有CsF的管道时,仅需7 min就可获得NCF3(Ts)阴离子。随后,作者通过离去基团来评估NCF3阴离子的反应性,结果显示阴离子与有效的离去基团才可进行反应。对于苄基底物,溴化物、碘化物、甲磺酸酯和对甲苯磺酸酯能以59-98%的产率获得产物4,而氯化物、乙酸酯、三氟乙酸酯和Katritzky盐亲电试剂却未能进行反应;对于正己基底物,碘化物在三氟甲烷磺酸银的存在下能以99%的产率获得三氟甲基烷基胺5,同时溴化物、甲磺酸酯和对甲苯磺酸酯也能以中等产率获得相应产物。
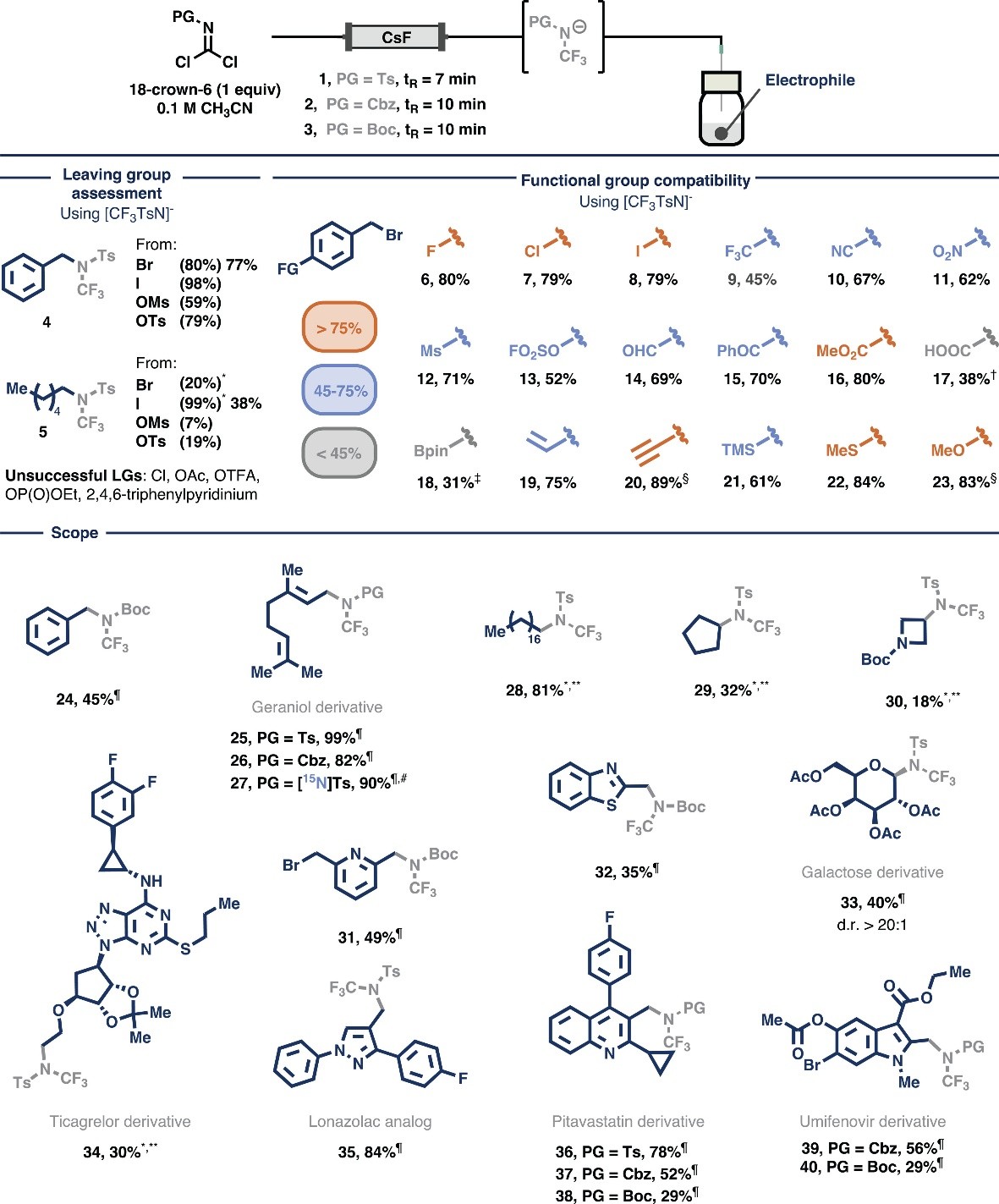
图2. NCF3(PG)的发展及其底物拓展。图片来源:Science
接下来,作者探索了NCF3(Ts)阴离子与不同官能团的兼容性(图2),即将CsF填充床中产生的对甲苯磺酰基保护的阴离子与一系列4-取代苄基溴进行反应,结果显示对位带有卤素(6-8)、强吸电子基团(9-13)、羰基衍生官能团(14-16)、游离羧酸(17)、硼酸酯(18)、乙烯基(19)、乙炔基(20)和供电子基团(21-23)的苄基溴均能兼容该反应,以中等至较好的产率获得相应产物。其次,作者还对亲电试剂的底物范围进行了考察,结果显示带有不同保护基的NCF3片段在80℃反应2 h即可成功组装苄基和烯丙基(24-26),特别是15N CF3(PG)也能以90%的产率获得15N标记产物27。值得一提的是,伯烷基和仲烷基碘化物(28-30)、氮杂芳基溴化物(31、32)、Ac保护的半乳糖基溴化物(33)以及多种API中间体衍生物(34-40)均可顺利实现这一转化,尽管底物28-30需要加入三氟甲烷磺酸银并延长反应时间。

图3. SCF3和OCF3的发展及其底物拓展。图片来源:Science
最后,作者对SCF3和OCF3片段的引入进行了研究,具体而言:分别选择硫光气(41)和双光气(42)作为三氟甲硫基阴离子[(SCF3)-]和三氟甲氧基阴离子[(OCF3)-]的前体,并通过条件优化成功地获得硫/氧属-三氟甲基亲核试剂,其中三氟甲硫基阴离子的停留时间低至5 min,三氟甲氧基阴离子的停留时间低至 7 min。在最优条件下,作者探索了亲电试剂的底物范围(图3)。对于SCF3片段,作者发现伯烷基(43-44)和仲烷基(45-46)亲电试剂、苄基和烯丙基底物(包括塞来昔布衍生物,47-49)均能兼容该反应,以中等至优异的产率(41-98%)获得相应的三氟甲硫基化产物,特别是底物47-49还能以伸缩流动的方式高效进行,将反应时间从2 h缩短到5 min,同时保持相似的产率。值得一提的是,生成的SCF3阴离子还能进行芳香亲核取代反应并生成相应的Csp2-SCF3产物(50),以及亲核酰基取代反应并生成所需的硫酯(51-52)。对于OCF3片段,仲烷基溴代物(53)、具有多个官能团和杂环骨架的烯丙基和苄基底物(54-59)均能顺利实现这一转化,以良好至优异的产率得到所需产物。类似地,三氟甲氧基阴离子也可以进行芳香亲核取代反应(60),并可以修饰糖基底物(61和62)。需要指出的是,该反应还可以拓展至较长的聚氟乙氧基链,即通过使用氟烷基酸酐作为阴离子前体流过CsF填充床,这些底物首先经历酰氟形成,然后在第二次氟化物加成时形成烷氧基阴离子,获得了四氟乙氧基和五氟乙氧基衍生的糖基产物(63和64)。
总结
Timothy Noël课题组利用流动化学策略,以氟化铯作为唯一氟源,将市售可得/易制备且稳定的有机前体按需转化为极具反应性的三氟甲基-杂原子阴离子,CF3-N、CF3-S和 OCF3-O。它们与合适的亲电试剂进行反应便可形成新的C-N、C-S或C-O键。该策略避免使用对环境有害的全氟烷基前体试剂,为更可持续的氟化合物合成开辟了新策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A unified flow strategy for the preparation and use of trifluoromethyl-heteroatom anions
Mauro Spennacchio, Miguel Bernús, Jelena Stanić, Daniele Mazzarella, Marco Colella, James J. Douglas, Omar Boutureira, Timothy Noël
Science, 2024, 385, 991–996. DOI: 10.1126/science.adq2954
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号