贵州大学/A*STAR JACS:卡宾亚磺酰基唑鎓中间体及S(IV)中心手性构建
近二十年来,小分子催化在立体选择性合成得到了极大发展,特别是以氮杂环卡宾(NHC)为代表的有机小分子催化剂在不对称催化中得到了广泛的应用。N-杂环卡宾(NHC)是一类研究颇为广泛的有机小分子催化剂,经典的NHC催化大都基于“碳中心”活性中间体(如:Breslow、Homoenolate、酰基唑鎓等),实现了Benzoin、Stetter以及其他诸多C-C/杂原子键形成反应。此外,非羰基底物的活化反应也有相应的报导。Fu、Glorius、Lupton、Matsuoka等研究发现亲核活化对缺电子双键,如丙烯酸酯,通过Deoxy-Breslow或其它活性中间体进行反应(图1A-ii,左)。最近,Lupton、Biju、Fu、Suresh等团队发现了一种独特的Aza-Breslow中间体及其衍生的亚胺偶氮中间体,实现了各种含氮杂环的制备。与基于“碳中心”的NHC活性中间体相比,含杂原子(如硫)中心的NHC活性中间体研究非常匮乏,而一旦实现,将为选择性构建碳-杂原子键提供又一新的研究思路。查阅文献发现,目前仅有Lupton等发现一种新的硫杂α,β-不饱和酰基唑鎓(α,β-不饱和磺酰基唑鎓),通过NHC催化与烯醇酸酯反应制备δ-磺酮(图1B)。值得注意的是,Lupton的工作中也开展了不对称催化研究,通过使用手性NHC催化剂合成δ-磺酮产物具有一定的立体选择性(73:27 er)。然而,基于杂原子(如硫等)为中心的卡宾中间体研究仍非常匮乏,特别是利用卡宾催化剂调控,高立体选择性地合成含杂原子手性中心功能分子依然是一个相当大的挑战。
硫中心手性化合物广泛应用于药物分子、农药分子、配体和有机催化剂合成设计当中(图1C)。相应地,含S-立体中心的化合物制备引起了相当大的关注,特别是近几年,国内外课题组利用各种催化策略取得了不少优秀的研究成果。池永贵教授团队专注于在有机合成和绿色药物农药研发生产领域展开创新性工作。近日,池永贵教授团队伍星星等人通过开发一种新型的“非碳”硫杂原子为中心的亚磺酰基唑鎓中间体,成功实现了一种S(IV)中心手性化合物的催化调控新方法(图1D)。机理中,反应首先涉及亚磺酸钠和酰氯反应形成亚磺基混酐中间体(I),在芳基羧酸盐的辅助下,混合酸酐(I)硫中心容易发生翻转,接下来在卡宾催化剂进攻下形成关键的亚磺酰基唑鎓中间体(II),从而调控与醇亲核试剂的不对称S-O键形成反应。所得的亚磺酸酯具有非常高的产率和立体选择性。经典的卡宾不对称催化多基于碳中心手性构建,此研究通过形成亚磺酰基唑鎓中间体,首次实现了“S”立体中心手性控制。此外,所获得的手性产物对水稻植物病原体具有显著抗菌活性,这对开发新型农药具有重要价值。
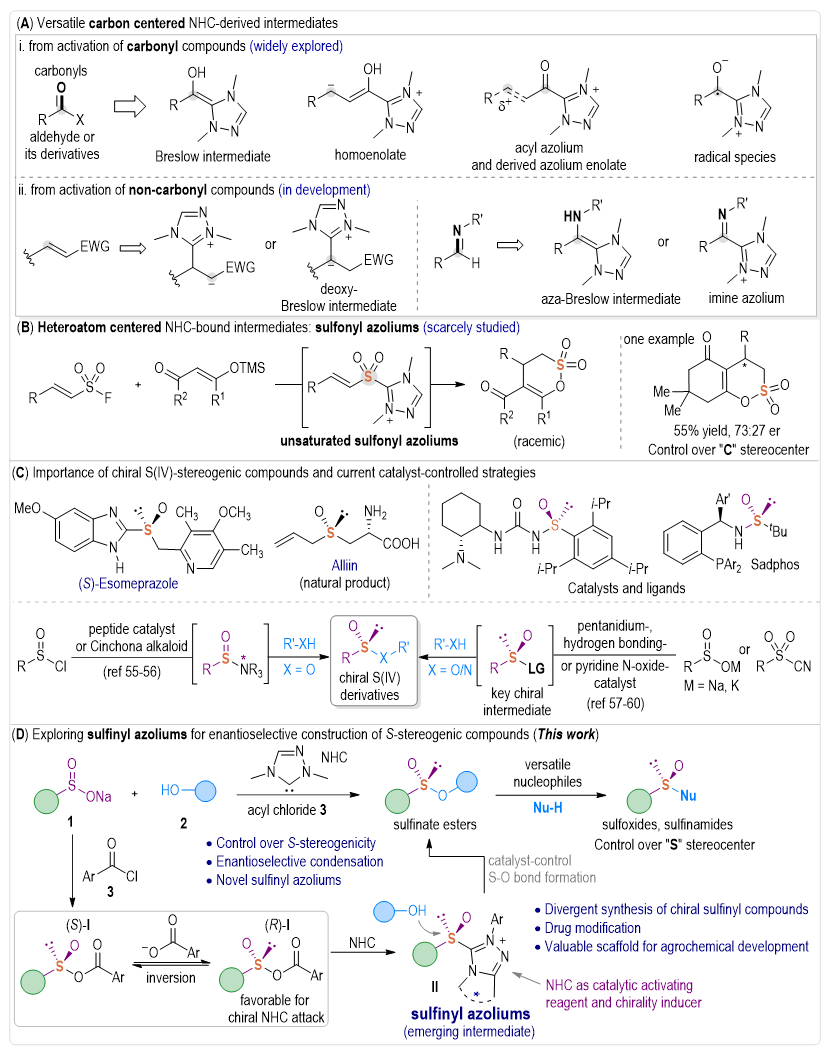
图1. 硫手性构建催化合成策略
首先,作者以2-噻吩亚磺酸钠1a和异丙醇2a为模型底物进行条件优化(图2)。作者首先考察了多种手性NHC催化剂A-G对控制产物5a的S-立体中心的能力。结果显示,催化剂G在产率和立体选择性方面表现出较好的效果(98%,82:18 er,entry 8)。考虑到形成混酐结构的差异性,作者还考察了多种酰卤或磺酰氯3b-3d,但未能找到更有效的活化剂。庆幸的是,在催化条件下,S-O键的形成效率很高,这能够使反应在相当低的温度(-60 ℃)下以81%的收率产生产物5a,并获得92:8的立体选择性。作者通过对不同添加剂的考察,发现在-60 ℃条件下加入硼酸4c,获得的手性产物5a具有优异的收率(96%)和高的立体选择性(95:5 er)。
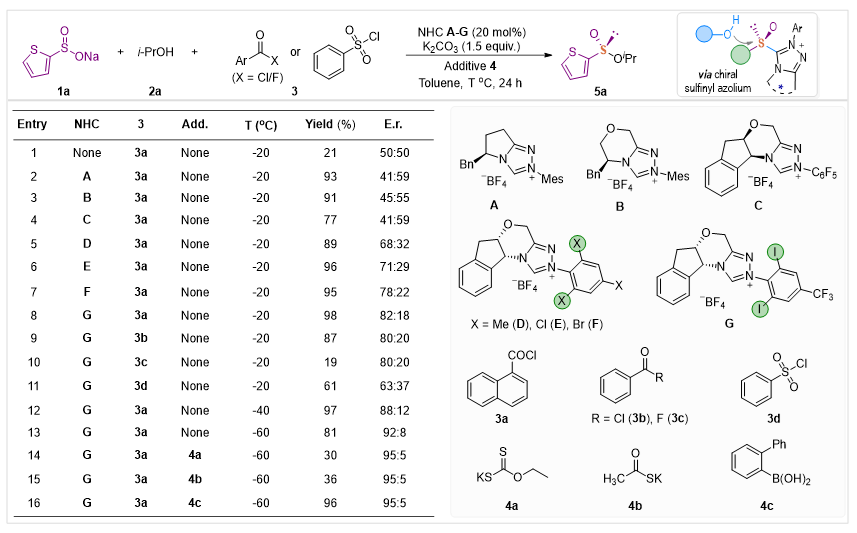
图2. 硫手性构筑催化条件筛选
在确定了最佳反应条件后,作者研究了NHC G催化合成手性亚磺酸酯的底物普适性(图3)。首先,作者能够在1a和2a之间进行克级反应,以90%的产率(1.0 g),在不影响立体选择性的状态下获得所需的产物5a。在最佳条件下,噻吩环的5位引入不同取代基均可兼容,以80-94%的产率和优异的立体选择性得到手性硫化物5b-5e。以苯并噻吩或苯并呋喃亚磺酸钠为底物进行反应时,得到了收率高、光学纯度高的亚磺酸酯5f和5g。在底物1芳基部分的对位、间位上引入不同取代基也均兼容,以76-95%的产率和优异的立体选择性得到手性硫化物5h-5u。值得注意的是,此方法也适用于烷基亚磺酸酯5v和5w的合成,但立体选择性略有降低。接下来,作者还探索了一系列醇,如乙醇、正丁醇、3-戊醇、环状醇及含杂原子环状醇,都能以优异的收率和立体选择性获得相应的手性亚磺酸酯产物(6a-6j)。此外,还能与天然醇(+)-蒎二醇和孕烯醇酮以中等收率和优异的立体选择性获得相应的手性亚磺酸酯产物(6k-6m)。与MeOH反应,产物6d的产率几乎是定量的,但立体选择性下降,可能是由于甲醇的亲核性较强的原因。
在合成一系列的亚磺酸酯后,作者尝试了其它的亲核试剂。如图3所示,在稍微改变反应条件后,能以优异的收率和高立体选择性制备了一系列亚磺亚胺产物6o-6u。尽管此方法是依赖于大位阻的胺亲核试剂来抑制背景反应,但对于选择性合成亚磺亚胺来说是一个显著的进步。
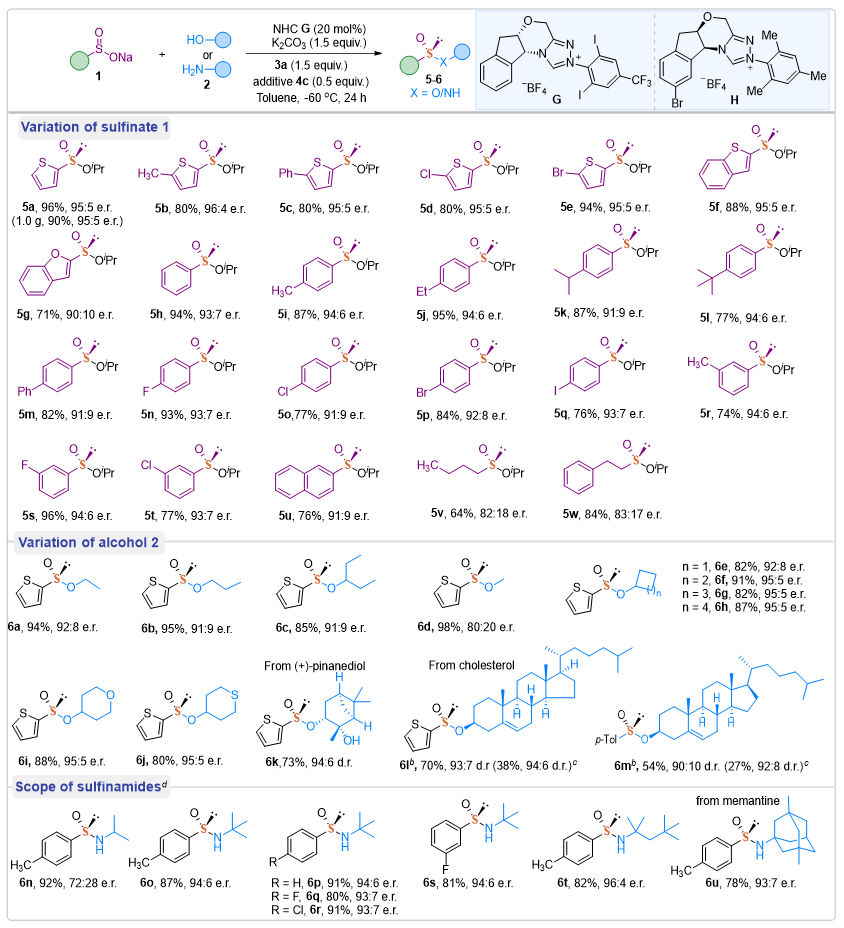
图3. 手性亚磺酸酯不对称合成研究
利用该方法所制备的手性硫化物为进一步转化提供了条件。例如,与各种格氏试剂的亲核加成得到高产率和立体选择性的亚砜产物(S)-7-9。此外,通过添加相应的亲核试剂可快速制备在不对称催化中具有应用潜力的双齿配体,如吡啶亚砜(S)-10。与相应的胺锂反应生成(R)-11-13和具有潜在生物学价值的杂环胺衍生物(R)-14-15。通过PhI=O氧化,(R)-5a很容易转化为亚磺酰亚胺酯(S)-16,该结构可作为一种极有潜力的药物骨架。此外,作者还探索了几种含有苯胺骨架的药物分子,如苯佐卡因、普鲁卡因,莫沙比利前体和美金刚得到它们相应的药物分子修饰结构17-20。所制备的亚砜胺6o通过氧化、亲核取代生成具有潜在药物骨架的亚磺酰亚胺酯21-22和亚磺亚胺23-24。
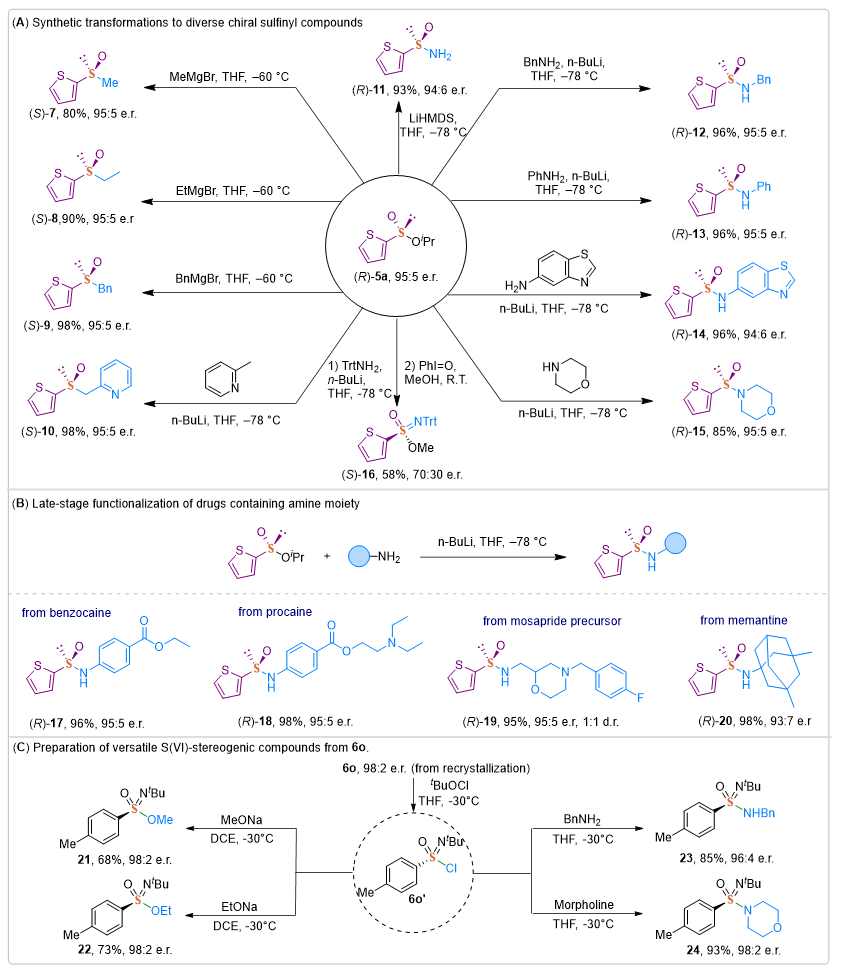
图4. 硫手性化合物多样性合成
通过控制实验研究其催化过程。如图5A所示,进行分步反应,获得混酐IA。在催化条件下,利用亚磺酸盐1i或亚磺酰氯1ii均可生成立体选择性好和产率优异的5i,与图3(87%,94:6 er)最佳催化条件下的结果相当。作者制备了简化的亚磺酰基唑鎓27。如图5B所示,化合物25和H2O2产生亚砜26。根据文献报道,26的N被甲基化后得到相应的亚磺酰基唑鎓27。然后在-40℃下,亚磺酰基唑鎓27与异丙醇反应生成亚磺酸酯(±)-5i,产率为60%。另外通过对各种NHC催化剂生成的亚磺酰基唑鎓的HRMS检测,验证了体系中所形成的NHC催化剂衍生的亚磺酰基唑鎓中间体存在。
新加坡科技研究局(A*STAR)章兴龙博士针对这一反应历程进行了DFT计算研究。混酐(±)-IB在1-萘甲酸盐的辅助下可以快速外消旋,能垒仅为3.5 kcal/mol。然后手性NHC G对混合酸酐进行立体选择性进攻,其中R_TS1(攻击(R)-IB)的能垒为12.2 kcal/mol, S_TS1(攻击(S)-IB)的能垒为14.3 kcal/mol,生成在反应条件下难以外消旋化的亚磺酰基唑鎓。通过TS2生成的产物是不可逆的。从吉布斯能量谱上看,静息态/转换频率决定生成的中间体(TDI)是混合酸酐IB与1-萘酸酯INT_A之间形成的络合物,而转换频率决定过渡态(TDTS)亚磺酰基唑鎓中间体TS1的形成。从总的吉布斯能谱显示,主要产物(从INT_A到R_TS1)的生成能长为14.8 kcal/mol,与-60℃下的反应性一致。R_TS1和S_TS1之间的吉布斯能差为2.1 kcal/mol,表明产物(R)-5a比(S)-5a更有利于生成,预测的e.r.为97:3,与观测到的e.r.为92:8较吻合。
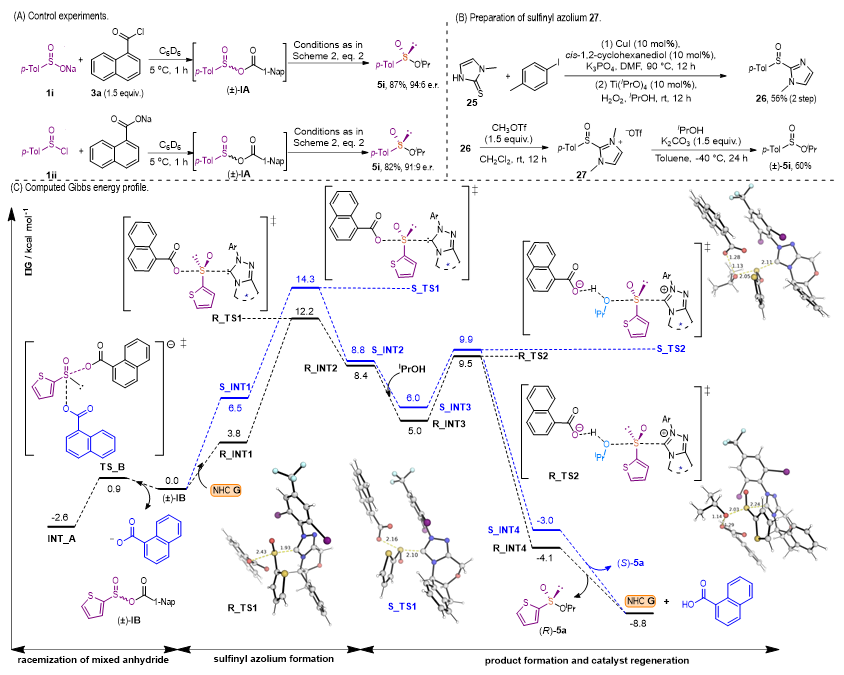
图5. 验证实验和DFT计算
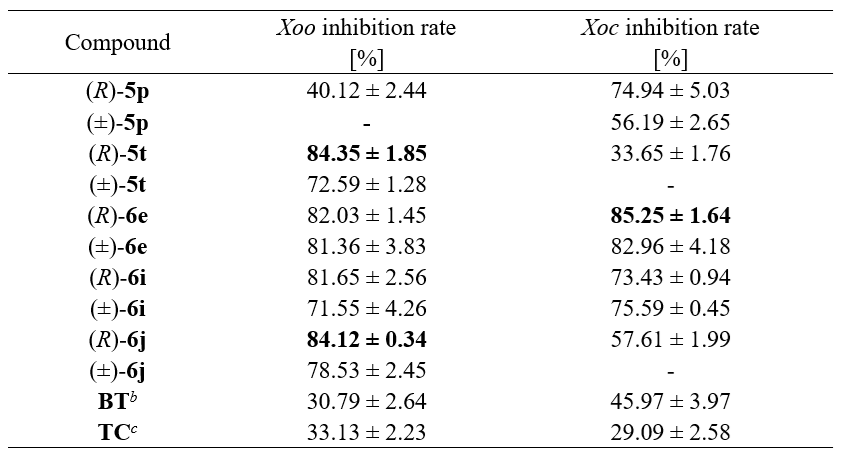
亚砜衍生物具有丰富的生物活性,作者对获得的手性亚砜衍生物的抗菌活性进行了初步研究,以寻找有效的抗菌农药用于植物保护。采用体外生物测定法评价其对两种植物病原菌Xoo (Xanthomonas oryzae pv) 和Xoc (Xanthomonas oryzae pv.) 的抑制活性。化合物(R)-5t和(R)-6j在浓度为50 μg/mL时对Xoo的抑制率分别为84.35%和84.12%,超过了阳性对照药噻菌酮(TC)和叶枯唑(BT)。同时,(R)-6e对Xoc的防治效果显著,优于TC (29.09%) 和BT (45.97%)。此外,5p、5t和6j外消旋化合物的抑制活性普遍略有降低。相关发现对于新型杀菌活性先导结构发掘及后续绿色农药创制具有重要意义。
表1. 部分化合物活性测试 (50 μg/mL)
总之,贵州大学伍星星/池永贵团队成功开发了一种NHC催化高效构筑手性亚砜衍生物的方法。在NHC催化混合酸酐的条件下,首次实现了卡宾亚磺酰基唑鎓新型活性中间体的形成,并以高产率和优异的立体选择性获得了一系列的硫手性化合物。此外,该方法还可以与各种天然产物和商业药物进行偶联反应,进而实现对重要生物分子的前药多样性修饰。新加坡科技研究局章兴龙老师通过DFT计算,解释了反应中所涉及的硫中心翻转动态动力学拆分关键步骤。此工作部分结果近期发表于J. Am. Chem. Soc.上。贵州大学绿色农药全国重点实验室、绿色农药与农业生物工程教育部重点实验室四年级博士生李本鹏为论文第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalyst Control over S(IV)-stereogenicity via Carbene-derived Sulfinyl Azolium Intermediates
Benpeng Li, Junyuan Hu, Minghong Liao, Qin Xiong, Yaqi Zhang, Yonggui Robin Chi, Xinglong Zhang*, Xingxing Wu*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c10486
通讯作者简介
章兴龙,博士,现任新加坡科学技术研究局(A*STAR)资深研究员,将于2024年10月入职香港中文大学化学系担任助理教授。2014年获得剑桥大学学士学位,2016年在牛津大学获得硕士学位,主修理论与计算化学,2019年在牛津大学获得博士学位,研究领域为计算均相催化,导师为Robert S. Paton教授。在完成美国加州理工学院 (Caltech,导师为Thomas F. Miller III教授)短暂的博士后研究,他于2020年10月加入新加坡A*STAR高性能计算研究所(IHPC)担任研究员。研究兴趣包括过渡金属催化的碳氢键活化和不对称有机催化中的计算机理研究。迄今为止已在顶级期刊发表30余篇论文,包括共同一作/通讯文章Nature Catalysis (1),Nature Chemistry (1), Nature Synthesis (1, accepted),Nature Communications (1),J. Am. Chem. Soc. (5),Angew. Chem. Int. Ed. (6),Chem (1),Chem. Sci. (3),ACS Catalysis (1)。
章兴龙
https://www.x-mol.com/university/faculty/364380
课题组主页:
https://xinglong-zhang.github.io
伍星星,教授,博士生导师,入选国家高层次青年人才项目(2021),贵州大学学术学科带头人,卓越人才专家,《农药学学报》期刊首届青年编委。2013年硕士毕业于华东师范大学,师从张俊良教授; 2017年博士毕业于新加坡南洋理工大学,指导老师池永贵教授; 2018年至2022年2月在瑞士巴塞尔大学Christof Sparr课题组从事博士后研究(欧盟“玛丽.居里”学者)。小组聚焦于“有机催化功能分子合成与新型农药活性先导骨架发掘”开展研究,主要包括:有机催化惰性化学键转化应用 (ACIE, 2023, e202303388; ACIE, 2023, e202310072) 以及催化剂调控平面及杂原子多层次手性中心高效构建与生物活性研究 (Chem 2024, 10, 1541; Nat. Commun. 2024, 15, 958; ACIE, 2024, e202404979; Sci. China Chem. 2024, 67, 2199; J. Agric. Food Chem. 2024, 72, 4622)。
https://www.x-mol.com/university/faculty/381897
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
贵州大学Nat. Commun.:动态构象异构驱动催化合成手性亚砜 2022-08-28
-
贵州大学绿色农药全国重点实验室Chem:有机催化硫中心手性构建 2024-03-21
-
卡宾催化不对称C-N键构筑及功能分子合成 2016-12-01
-
贵州大学绿色农药全国重点实验室Nat Commun:卡宾催化面手性大环内酯构建 2024-02-20
-
Controlling Transformation of Sorbitol into 1-Hexanol over Ru-MoOx/Mo2C Catalyst via Aqueous-Phase HydrodeoxygenationACS Sustainable Chemistry & Engineering (IF 7.1) Pub Date : 2021-06-28 ,DOI:10.1021/acssuschemeng.1c02014Xin Chen, Yanni Zheng, Qian Zhang, Songbai Qiu, Qingwei Meng, Xiaoping Wu, Tiejun Wang


































 京公网安备 11010802027423号
京公网安备 11010802027423号