中科院青岛生物能源与过程研究所丛志奇研究员课题组近年来工作概览
丛志奇研究员简介
丛志奇,中国科学院青岛生物能源与过程研究所研究员、十四五重大科研任务首席科学家。2009年熊本大学博士,2009年4月-2013年3月分子科学研究所博士后,2013年4月-2016年4月名古屋大学研究科学家。2016年5月加入青岛生物能源所任课题组长。主要研究方向为酶的化学生物学与合成生物学。代表性成果发表在Accounts of Chemical Research、Journal of the American Chemical Society、Angewandte Chemie International Edition、ACS Catalysis、Chemical Science等国际著名期刊上,相关论文多次被选为Very Important Paper、Hot Paper、Cover等,并被Natural Product Reports、ChemistryViews、Faculty Opinions等作为亮点报道。申请专利9项,其中7项已获授权。主持国家重点研发计划、国家自然科学基金和青岛市创新领军人才等项目和课题15项,获青岛市自然科学二等奖1项(第一完成人)。

丛志奇研究员近年来聚焦被誉为“万能生物催化剂”的细胞色素P450酶,先后提出了“双功能分子协同P450过加氧酶催化”、“氧化还原敏感残基工程”、和“H2O2隧道工程”等新概念和新策略(图1),为P450酶分子设计及其催化应用提供了新思路,拓展了非天然P450过氧化酶研究领域(Acc. Chem. Res. 2024, 57, 613, Supplementary Cover)。下面以丛志奇研究员近年来的代表性文章来简要介绍该课题组所取得的成果。
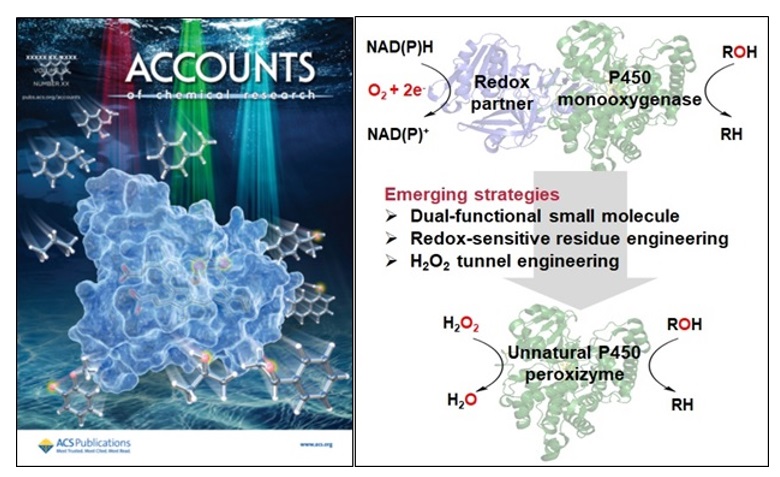
图1. 丛志奇团队发展的几个非天然P450过氧化酶创制新策略
(一)双功能小分子协同P450酶催化:概念、机理和进化
细胞色素P450单加氧酶能在温和条件下高选择性地催化惰性碳氢键羟化、烯烃环氧化、杂原子氧化等多种反应,在生物化工和有机合成等领域有巨大的应用潜力。然而,P450酶的催化应用收到昂贵辅因子NAD(P)H的复杂电子传递体系的限制。发展由H2O2直接驱动的非天然P450过氧化酶,是开发实用性P450酶生物催化剂的一个可选途径。
为解决大多数天然P450酶在H2O2的存在下的低活性甚至没有活性问题,丛志奇研究员在天然过氧化酶催化机制的启发下,创新性地提出一种名为“双功能小分子(DFSM)协同P450酶催化”的新策略(图2),引入一端带有酰基氨基酸作为锚定基团、另一端带有咪唑作为酸碱催化基团的DFSM分子,通过DFSM与P450BM3紧密结合、并协同血红素活性中心活化H2O2,成功将对H2O2低活性的天然P450酶转化为高效人工P450过氧化酶(Angew. Chem. Int. Ed. 2018, 57, 7628, Very Important Paper & Highlighted by ChemistryViews)。

图2. 双功能小分子辅助P450酶催化策略示意图
随后该团队与青岛能源所冯银刚研究员以及厦门大学王斌举教授合作,通过结构生物学和理论计算研究进一步阐明了DFSM协同P450酶催化的结构基础和分子机理:DFSM通过与P450蛋白的特异性相互作用稳定底物构象、进而使P450酶能够以异裂方式高效活化H2O2(图3),相比于没有DFSM存在时只能以均裂方式活化H2O2的P450,过加氧酶活性提高数十倍(ACS Catal. 2021, 11, 8774)。

图3. 双功能分子协同P450过加氧酶的晶体结构(a-d)与H2O2活化机理(e)。
该团队还根据晶体结构分析对DFSM的分子结构进行了再设计与优化,成功将DFSM进化为具有10 nM级、与部分天然辅因子亲和力接近的的新型可编辑人工辅因子(图4),开发出极具应用前景的双中心人工P450过加氧酶催化新体系(Angew. Chem. Int. Ed. 2023, 62, e202311259, Hot Paper & Cover)。
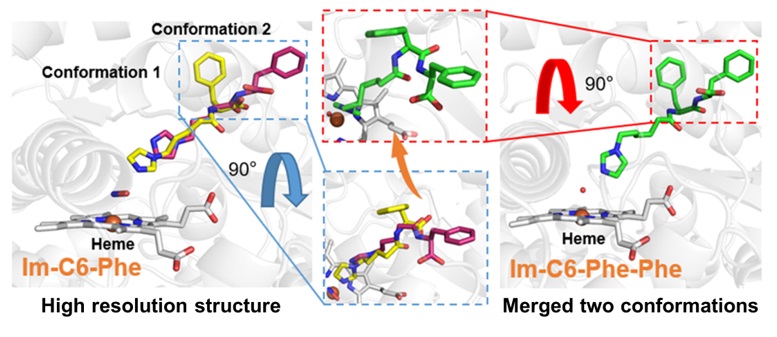
图4. 晶体结构指导的双功能小分子迭代进化。
(二)双功能分子协同P450过加氧酶的催化应用
碳-氢键选择氧化是有机合成化学领域的一个重大难题,面临着化学选择性、区域选择性和对映选择性等诸多挑战。丛志奇团队利用DFSM协同P450过加氧酶催化系统所具有的独特性质——即外源DFSM分子与P450酶蛋白对催化反应的双重调控,开发出一系列外源分子协同P450酶共进化的蛋白质工程新策略,获得了对多种高难度碳-氢选择氧化反应具有优异催化性能的非天然P450过加氧酶,代表性的例子包括:
1)首次实现对烷基苯全部潜在羟化位点中半数以上的高度区域和立体选择性羟化产物(图5A),化学选择性和区域选择性最高均可达>99%,对映选择性最高可达>99% ee,催化性能也远优于目前任何已报道的天然或工程P450酶(Angew. Chem. Int. Ed. 2023, 62, e202215088, Hot Paper);
2)首次获得以过氧化氢作为末端氧化剂的催化气态烷烃选择性羟化的高活性人工P450过加氧酶,对丙烷等低碳烷烃(C3-C6)的羟化选择性在99%以上,几乎没有过氧化的酮或醛生成(图5B),为开发催化天然气 “气液转化”利用的新型非天然生物酶催化系统提供了新思路(ACS Catal. 2019, 9, 7350);
3)获得了催化苯乙烯及其衍生物的高度(R)-对映选择性环氧化的工程P450过加氧酶(95%~99% ee)(图5C),弥补了天然酶或分子催化剂催化的苯乙烯环氧化在(R)-对映选择性控制方面的不足(Chem. Sci. 2021, 12, 6307, Back Cover & Highlighted by Nature Product Reports)。

图5. 双功能分子协同P450过加氧酶催化的典型选择氧化反应。A)烷基苯的区域多样性和对映选择性羟化;B)气态烷烃选择性羟化;C)高度(R)-对映选择性苯乙烯环氧化。
(三)氧化还原敏感残基工程调控P450的过氧化物酶功能及催化应用
该团队在P450酶化学机制指导下,创新性地提出“氧化还原敏感残基工程”策略,成功将双功能小分子协同 P450 过加氧酶转化为迄今为止最佳过氧化物酶活性的 P450 工程酶,可媲美或超过大多数天然过氧化物酶(图6)。这项研究为双功能分子协同 P450 酶催化体系拓展了新的应用空间(ACS Catal. 2021, 11, 8449, Recommended by Faculty Opinions)。

图6. 氧化还原敏感残基工程实现P450过加氧酶到过氧化物酶功能转化
该团队进而结合氧化还原敏感残基工程与底物口袋工程策略,在过加氧反应中起关键作用的氨基酸位点引入空间位阻效应,强化其过氧化物酶功能,首次成功实现了人工 P450 过氧化物酶催化不饱和烃的直接硝化,底物谱范围覆盖 19 个酚类和芳香胺化合物以及 9 个末端芳基烯烃化合物(图7),为开发条件温和的直接硝化反应提供崭新的非天然生物硝化酶新途径(Angew. Chem. Int. Ed. 2023, e202217678)。
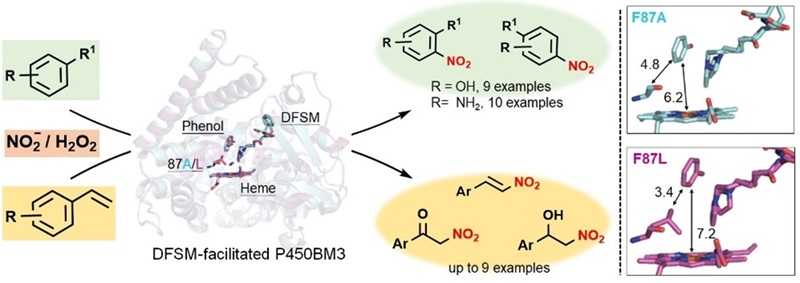
图7. 人工P450 硝化酶催化的不饱和烃直接硝化
(四)H2O2隧道工程策略
最近,该团队通过工程化P450过氧化酶与天然过氧化物酶和过加氧酶的结构对比分析,创新性地提出了“H2O2隧道工程”的酶工程策略。通过改造P450酶的固有水隧道,增强H2O2向活性中心的流入,成功将两种NADH依赖型P450单加氧酶转化为高活性的工程化P450过加氧酶(图8)。此外,将上述策略应用到双功能分子协同P450过加氧酶体系,使H2O2与产物的耦合效率达到95%。为将P450单加氧酶改造为过加氧酶提供了一个普适性新策略(J. Am. Chem. Soc. 2023, 145, 5506)。

图8. 过氧化氢隧道工程策略
以上为丛志奇研究员课题组近年来具有代表性的工作成果,其它更多具体详细的信息请参考该课题组的网站:http://congzq.qibebt.ac.cn/,或发送邮件至congzq@qibebt.ac.cn进一步讨论。此外,该课题组欢迎有志于科研工作并对其研究方向感兴趣的同学联系报考硕士/博士以及博士后岗位。

导师介绍
丛志奇
https://www.x-mol.com/university/faculty/69036
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
中科院青能所丛志奇研究员Angew:工程化P450酶实现不饱和烃直接硝化 2023-02-19
-
外源分子协同P450酶工程新策略实现碳-氢键区域和立体多样性羟化 2022-12-17
-
理性设计P450过加氧酶的隧道工程新策略 2023-03-12
-
人工P450过加氧酶催化小分子烷烃选择性羟化 2019-08-07


































 京公网安备 11010802027423号
京公网安备 11010802027423号