Nat. Catal.封面:金属酶催化实现外消旋α-卤代羰基底物对芳烃的立体选择性自由基环化反应
酶作为高效的生物催化剂,能够精确控制不对称催化转化中的立体选择性,可以作为一种强有力工具用于手性分子骨架的高效构建。然而,由于酶天然反应性的问题,其参与构建的手性分子范围十分有限。为解决这个问题,研究者通过天然酶的重新利用和定向进化来拓展酶的功能范围,催化非天然反应。在自然界中,自由基酶(如自由基S-腺苷甲硫氨酸(SAM)酶)能以优异的选择性和新颖的机制实现一些具有挑战性的自由基转化,但尚未在合成化学和生物技术中得到广泛应用。近年来,研究者在非天然自由基生物催化领域中已开发出几种不同的活化模式来实现开壳中间体的立体选择性转化,例如:1)利用强还原激发态黄素和烟酰胺辅因子,实现了光酶催化的不对称自由基反应;2)基于常见金属蛋白中第一排过渡金属辅因子的天然氧化还原活性,利用血红素和非血红素铁酶通过金属氧化还原策略催化立体选择性原子转移自由基反应。

当期封面。图片来源:Nat. Catal.
近日,美国加州大学圣巴巴拉分校的杨扬教授研究团队利用金属氧化还原生物催化策略,通过非天然电子转移机制重新利用天然细胞色素P450来催化外消旋α-卤代羰基底物对芳烃的不对称自由基环化反应。具体过程如下(图1a):首先,血红素铁蛋白催化剂与烷基卤化物I经单电子转移(SET)生成高活性自由基物种II,再与芳环体系发生自由基加成获得去芳构化自由基中间体III,接着与铁血红素蛋白进行自由基-极性交叉便可获得最终产物,同时再生铁蛋白催化剂并完成催化循环。值得一提的是,作者基于定向进化获得了一系列工程化P450芳香自由基环化酶:其中P450arc1和P450arc2可促进外消旋α-溴代羰基底物的立体汇聚式转化,以优异的总周转数(高达12000)获得两种不同构型的对映体(图1b);而P450arc3则能实现外消旋氯化物的有效动力学拆分(图1c)。相关成果以封面文章发表在Nature Catalysis 上,第一作者为付文振博士,共同通讯作者为刘鹏教授(匹兹堡大学)和杨扬教授。
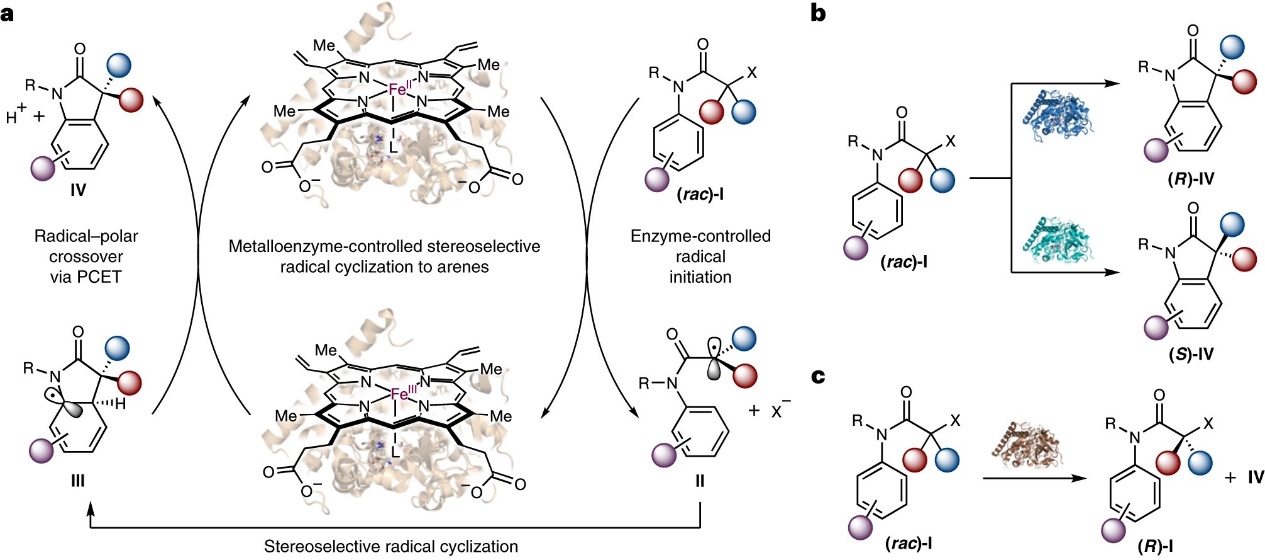
图1. 用于立体选择性自由基环化的金属酶平台。图片来源:Nat. Catal.
首先,作者选择α-溴-β-酰胺酯1为模型底物、完整的大肠杆菌细胞为生物催化剂对一组血红素蛋白及其变体(如:细胞色素P450、球蛋白、细胞色素c以及进化的自由基环化酶突变体)进行筛选(图2a),结果显示多种血红素蛋白具有反应活性,但仅有少数细胞色素P450突变体显示出中等的对映选择性,例如:P411Diane2(产率:58%,(S)-2a:(R)-2a=66:34)和P411Diane3(产率:62%,(S)-2a:(R)-2a=36:64)。随后,作者以P411Diane2和P411Diane3作为这种新型酶功能的初始靶点,通过定向进化来提高非天然自由基环化的对映选择性(图2b-d),结果显示P411Diane2经过四轮定向进化后鉴定出有益突变W263Q、L181M、T438G和H266L(即P450arc1),并且在残基263处新引入的谷氨酰胺可能通过氢键与酰胺底物的羰基键合,进而促进底物活化并提高反应的对映选择性。在标准条件下, P450arc1能以77%±3%的产率、1330±50的TTN和96:4 e.r.值获得自由基环化产物(S)-2a(图2c)。类似地,P411Diane3经过定向进化后鉴定出5个有益突变G437A、V327P、N70S、A330F和G74P(即P450arc2),其参与的反应可以88%±1%的产率、1890±30的TTN和12:88 e.r.值获得所需产物(R)-2a(图2d)。此外,稳态动力学实验表明P450arc1的kcat为0.54±0.03 s-1,相对于亲本酶P411Diane2(kcat= 0.036±0.004 s-1)提高了15倍,并且P450arc1的KM与亲本酶相似。
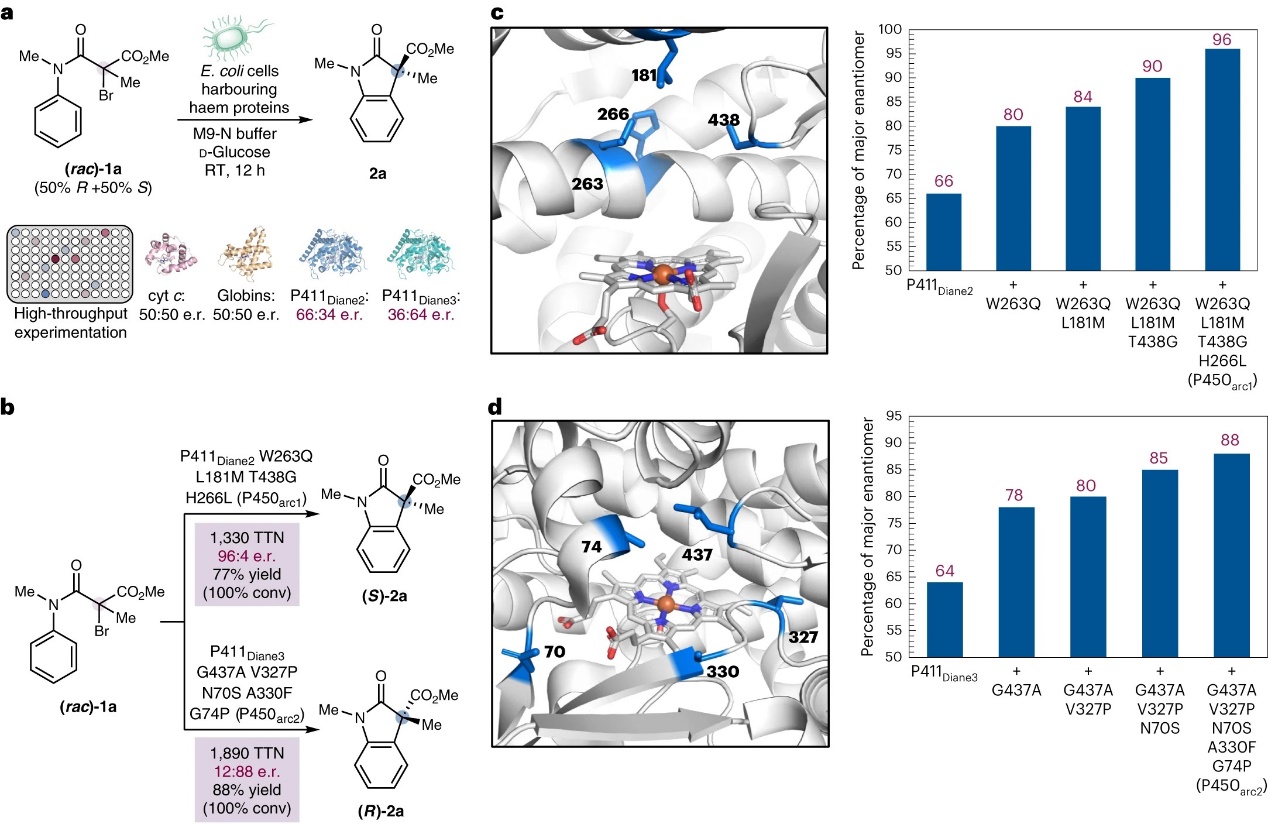
图2. 条件筛选。图片来源:Nat. Catal.
在最优条件下,作者对该反应的底物范围进行了考察(图3a),结果显示α-位不同基团(如:甲基(2a)、乙基(2b)、丙基(2c)、烯丙基(2d)、异丙基(2e))和芳环对位不同基团(如:氟原子(2f)、氯原子(2g)、溴原子(2h)、碘原子(2i)、甲氧基(2j)、甲基(2k)、乙基(2l)、异丙基(2m))取代的底物、乙酯底物(2n)以及N-乙基底物(2o)均能兼容该反应,以良好至优异的产率、优异的TTN和对映选择性获得相应产物,特别是产物2b和2i还能进行克级规模制备且产率和对映选择性没有降低。值得注意的是,作者还通过X-射线衍射分析确定了产物2i的绝对立体化学。此外,通过降低全细胞生物转化的细胞密度(OD600=30、20、10、5),进化酶能以高达12000±300 TTN获得所需产物2b(图3c),并且产率(88%)和对映选择性(98:2 e.r.)仍能保持。另一方面,当间位取代的芳烃(1p)进行反应时,P450arc2无需进一步修饰就能克服固有的底物选择性,并以78:22的区域异构体比、1530±50 TTN和85:15 e.r.值获得主要产物para-2p;而先前开发的光氧化还原和小分子Cu催化的自由基环化反应则合成了外消旋羟吲哚2p并且p-2p:o-2p≈1:1(略微有利于o-2p),进一步展现出金属酶对自由基介导的转化进行区域控制的潜力。
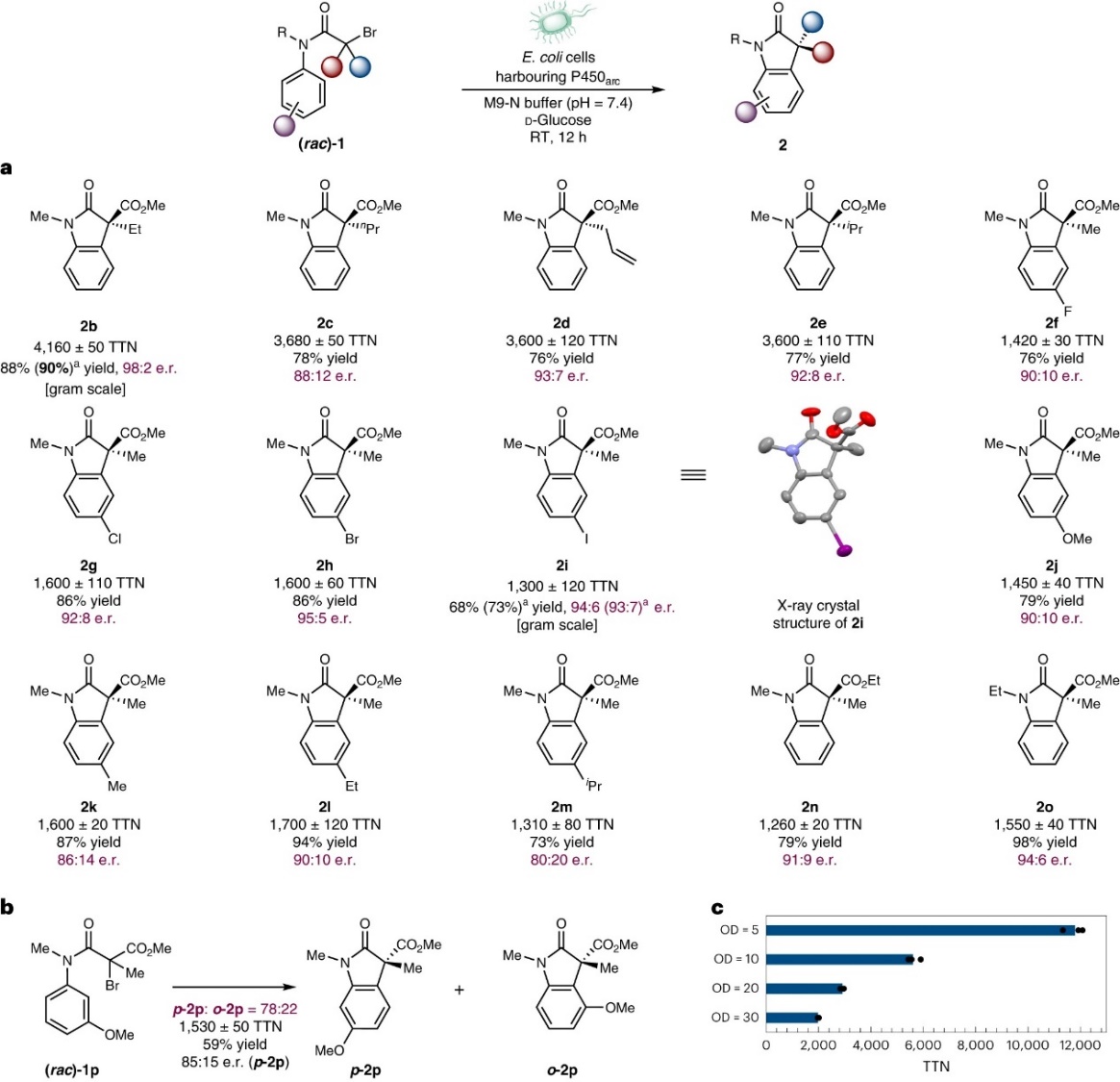
图3. 底物拓展。图片来源:Nat. Catal.
随后,作者将金属酶介导的自由基过程拓展至α-氯代底物的转化,研究表明P450arc1和P450arc2-P74G-L436R-F330V能够有效实现氯化物(3a)的对映汇聚式转化(图4a),具体而言:在优化的反应条件下(OD600=120),P450arc1能以85%的产率、450±60 TTN和94:6 e.r.值获得产物(S)-2a;而在相同的条件但较低的细胞密度(OD600=30)下,P450arc2-P74G-L436R-F330V能以64%的产率、1200±110 TTN和12:88 e.r.值制备(R)-2a。值得一提的是,该进化谱系的另一种酶变体P450arc3(P450arc1-G438T-L266H-L78C-V328E-S332A)能够有效实现3a的动力学拆分(图4b),以45%的产率和94:6 e.r.值获得(R)-3a,同时还能以55%的产率和64:36 e.r.值获得环化产物2a。此外,作者还发现与P450arc3进行更快自由基环化的对映体底物(S)-3a在α-位置的立体化学与环化产物主要对映体(S)-2a相同。
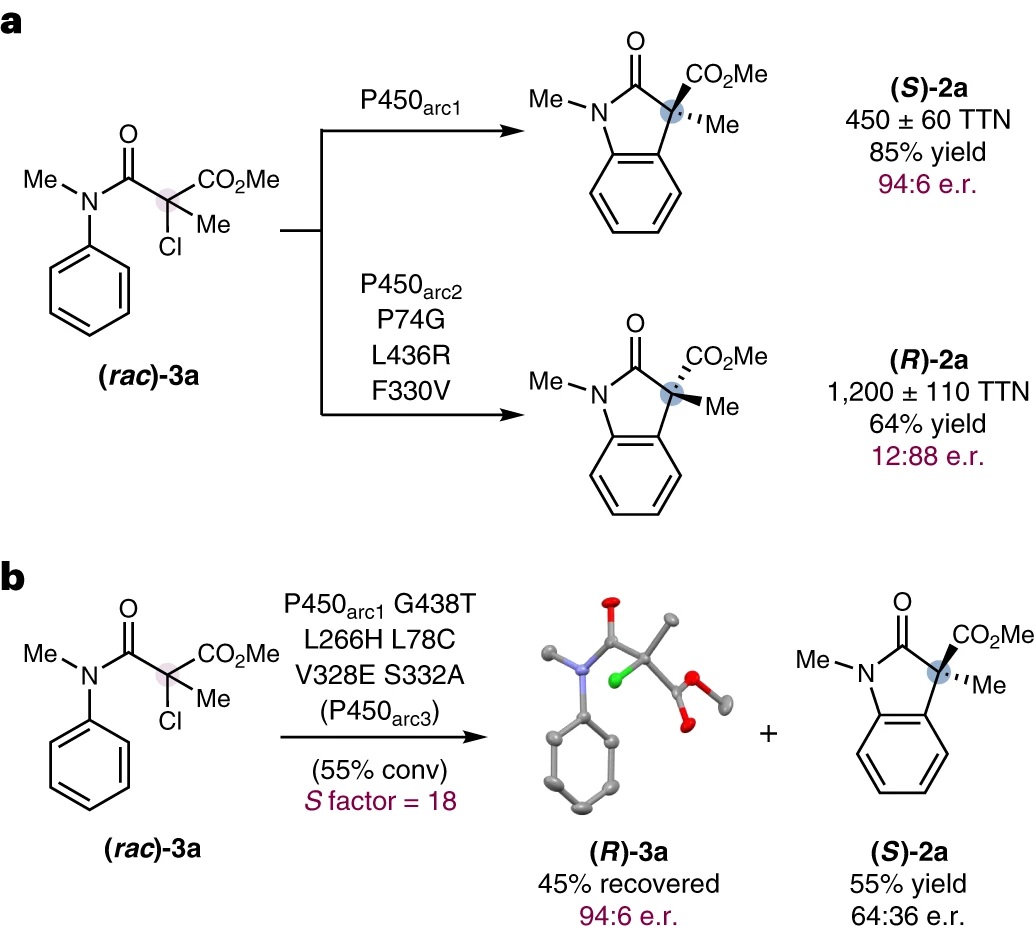
图4. P450催化α-氯代底物3a的立体选择性转化。图片来源:Nat. Catal.
接下来,作者进一步研究了P450arc酶催化α-溴化物1b和α-氯化物3a的对映汇聚性自由基环化过程,对生成产物和剩余底物的e.r.和转化率的关系进行了仔细分析。如图5a所示,α-溴化物1b在P450arc2的作用下进行反应时,产物2b的e.r.值在整个反应过程中保持恒定(97:3),并且反应的主要对映体产物为(R)-2b。而后随着反应的进行,在回收的底物1b中观察到(S)-1b的逐渐富集,存在较低的底物动力学拆分选择性,S因子很小(1.4±0.1)。因此,虽然(R)-1b相对于其对映体(S)-1b的转化速度更快,但由(R)-1b和(S)-1b衍生的产物2b表现出相同的e.r.值。其次,尽管1b在P450arc1的作用下进行反应时易获得产物(S)-2b(图5b),但(R)-1b的转化速度仍然更快。随着反应的进行,产物2b的e.r.值增加,进而表明反应缓慢的对映体(S)-1b以略高的e.r.值转化为2b。与P450arc2类似,P450arc1对底物也表现出较低的动力学拆分选择性(S因子=1.8±0.1)。有趣的是,α-氯化物3a在P450arc1的作用下进行反应时获得主要对映体产物(S)-2a(图5c),产物2a的e.r.值随着转化逐渐降低,表明反应缓慢的对映体(S)-3a以略低的e.r.值转化为2a,并且对底物也表现出较低的动力学拆分选择性,S因子为3.4±0.5。综上所述,对于所有新开发的对映汇聚式转化生物催化剂,都能以优异的对映选择性将外消旋底物转化为产物;并且作者观测到了在不同突变体P450arc1和P450arc2催化消旋底物的过程中,都存在较低的底物动力学拆分选择性,虽然底物最终都可以完全转化生成手性富集的产物;并且观察到了产物e.r. 的三种不同变化过程,该结果进一步阐释了酶催化过程中对映汇聚性手性控制的复杂性。
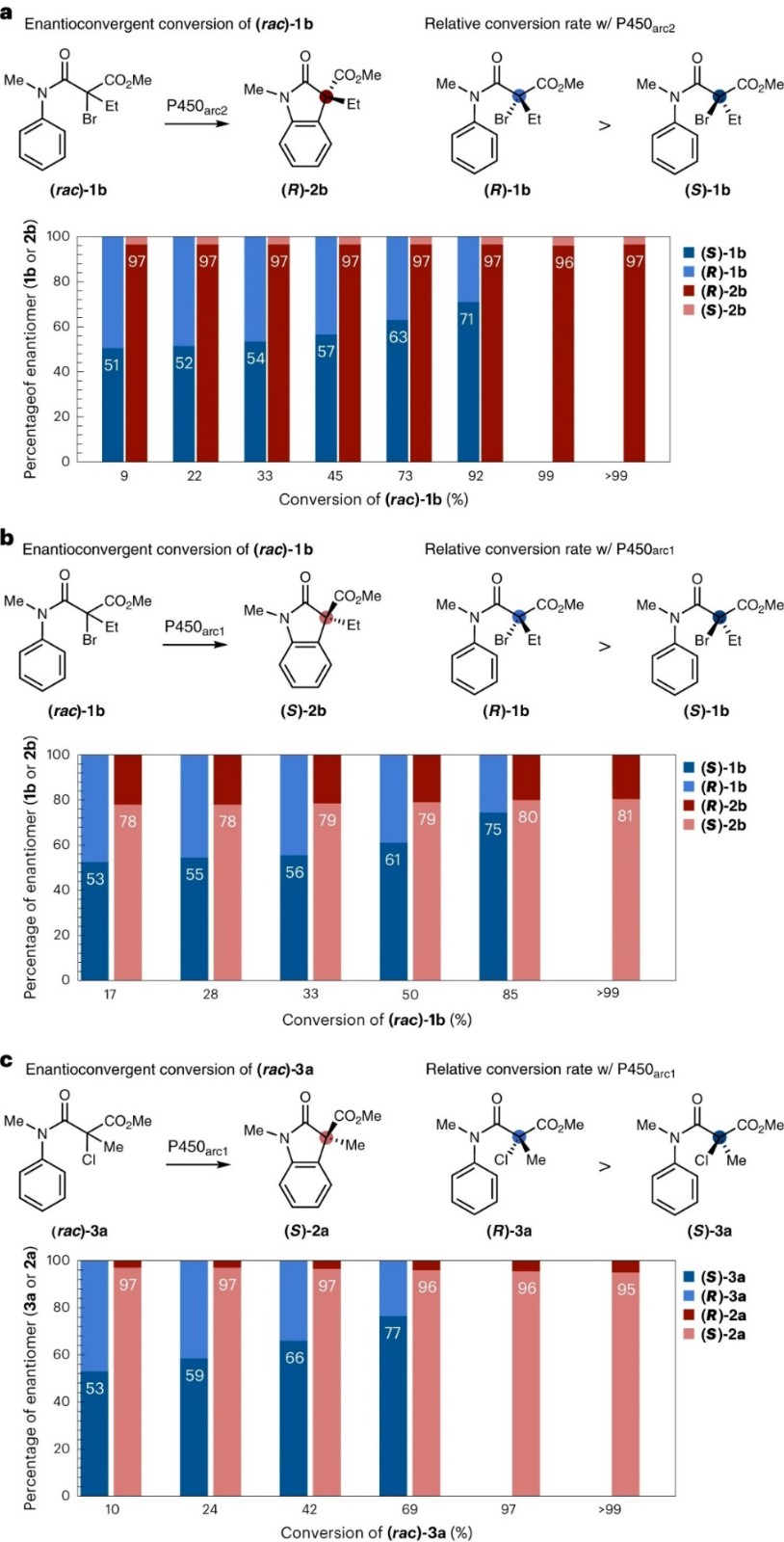
图5. P450催化对映汇聚式自由基环化过程的时间过程。图片来源:Nat. Catal.
为了进一步探究反应机理,作者使用铁卟啉模型进行了密度泛函理论(DFT)计算(图6),结果表明:1)Fe卟啉催化剂在整个催化循环中保持高自旋状态。由于α-溴-β-酰胺酯1a中的C-Br键相对较弱,因此Fe催化自由基引发生成α-羰基自由基4a高度放热;2)该机制中自由基引发步骤更倾向于外球解离电子转移机制(ΔG‡=2.0 kcal mol-1)而非内球电子转移途径(TS1,ΔG‡= 15.5 kcal mol-1);3)随后自由基环化过程的活化能垒为14.2 kcal mol-1,这表明自由基4a具有足够的寿命,可以进行必要的构象变化和C-C键旋转,实现外消旋起始底物的对映汇聚式转化;4)对于自由基-极性交叉步骤,最有利的机制是协同质子-电子转移(CPET),并且血红素辅因子的羧酸基团可能作为碱催化剂促进自由基-极性交叉过程(酶活性位点的其它碱性残基也可能作为碱性催化剂),从而证明血红素辅因子作为双功能催化剂的潜在作用,大大降低了自由基-极性交叉的活化势垒;5)DFT计算表明CPET过程更有利,这是因为其绕过了由逐步电子或质子转移引起的高能中间体的形成;6)CPET较低的活化能垒且不可逆使得自由基中间体8a可以被快速且不可逆地捕获,因此自由基环化是酶催化对映选择性决定步骤,这与动力学同位素效应实验结果相一致。
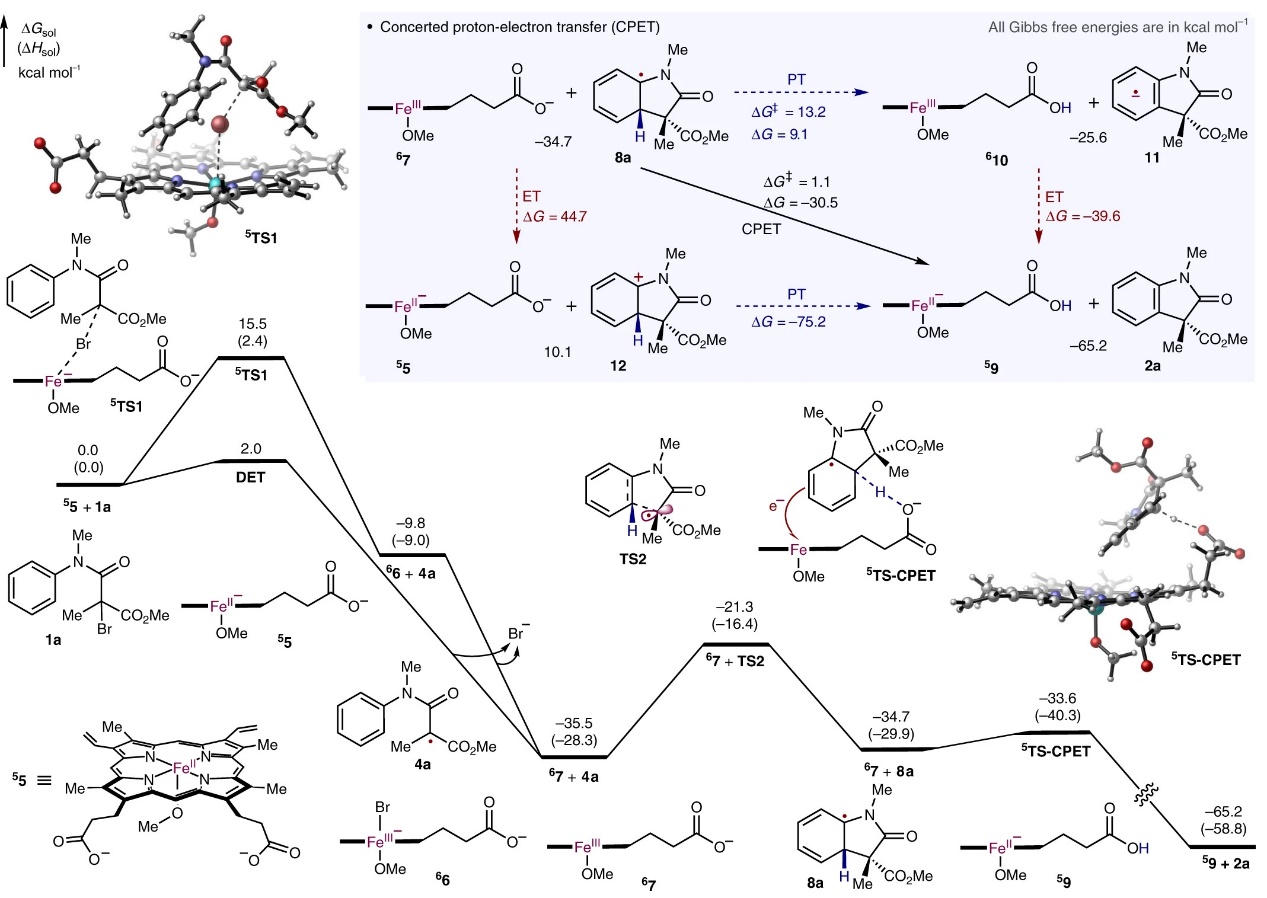
图6. 机理研究。图片来源:Nat. Catal.
总结
本文研究团队利用金属氧化还原生物催化策略,通过非天然电子转移机制重新利用天然细胞色素P450来催化外消旋α-卤代羰基底物对芳烃的不对称自由基环化反应。值得一提的是,他们基于定向进化获得了一系列工程化P450芳香自由基环化酶:其中P450arc1和P450arc2可促进外消旋α-溴代羰基底物的立体汇聚式转化,而P450arc3则能实现外消旋氯化物的有效动力学拆分。此外,DFT计算研究揭示了自由基-极性交叉步骤的质子耦合电子转移机制,并表明血红素羧酸盐作为碱催化剂的潜在作用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enzyme-controlled stereoselective radical cyclization to arenes enabled by metalloredox biocatalysis
Wenzhen Fu, Natalia M. Neris, Yue Fu, Yunlong Zhao, Benjamin Krohn-Hansen, Peng Liu, Yang Yang
Nat. Catal., 2023, 6, 628-636. DOI: 10.1038/s41929-023-00986-5
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
























































 京公网安备 11010802027423号
京公网安备 11010802027423号