“活性不打折”的新骨架手性联吡啶配体与不对称催化
结构与其镜像不能完全重叠的特征,即手性,在生命进化和人类健康领域扮演了重要作用。不对称催化反应是选择性人工合成手性物质的主要方法,而实现这种选择性的关键在于寻找合适的手性催化剂。在该领域我国科学家做出突出贡献,产生了一系列特色鲜明、应用广泛的催化剂及其中控制选择性的关键部分——手性配体。
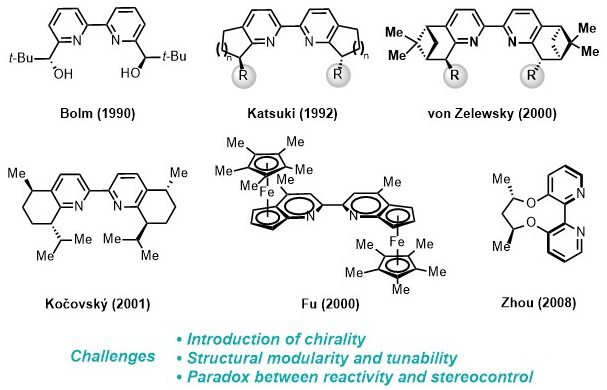
图1. 文献报道的代表性手性联吡啶配体
但是,有一类历史悠久、应用广泛的配体,即吡啶类配体,至今仍缺乏有效的手性版本(图1)。半个世纪以来,许多化学家尝试发展手性吡啶配体,但在同时解决三方面主要挑战中遇到困难:第一,向吡啶平面引入手性元素;第二,在骨架上方便地进行结构改造;第三,在吡啶环旁边引入取代基时,立体选择性的提高常常伴随催化活性的降低。这些困难激发了化学家极具创意的配体设计思想。例如,大连化物所周永贵研究员发展了柔性链调控的轴手性联吡啶配体,并已在若干反应中取得优秀结果。另外,在有些反应中人们用噁唑啉或胺等替代吡啶,但常常导致活性打折,且难以满足众多反应的需求。因此,手性吡啶类配体的设计仍是亟待解决的一个重要挑战。
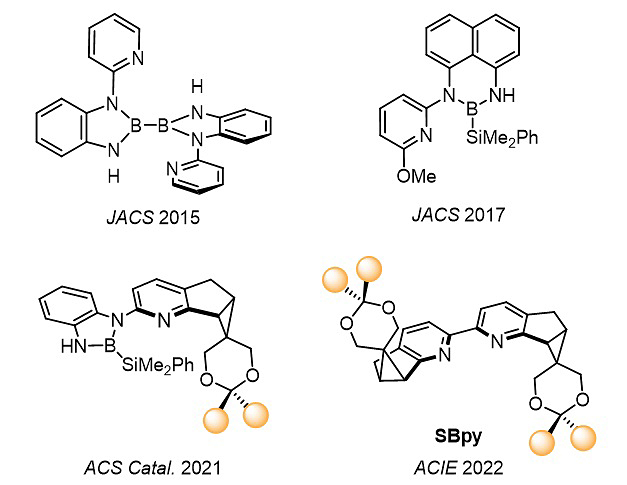
图2. 李鹏飞课题组设计的系列吡啶衍生配体
西安交通大学李鹏飞(点击查看介绍)课题组多年来发展了一系列吡啶衍生配体(图2),特别是近年的报道证明其独创的N,B-双齿配体在C-H键硼化反应中具有优异效果。近期,李鹏飞课题组针对上述手性联吡啶设计难题,通过从头合成、预留修饰基团和结构设计,建立了一类新骨架手性联吡啶配体SBpy(图3)。根据键角和二面角的分析,SBpy刚性的[6-5-3]稠环结构实现了中心金属近程位阻的最小化,而侧链的环状缩酮则提供了结构灵活改造位点,从而克服了立体选择性和催化活性之间的矛盾。SBpy这种“内松外紧”的结构特征不同于传统手性配体的设计思路,而与广谱性酶如细胞色素P450异曲同工。
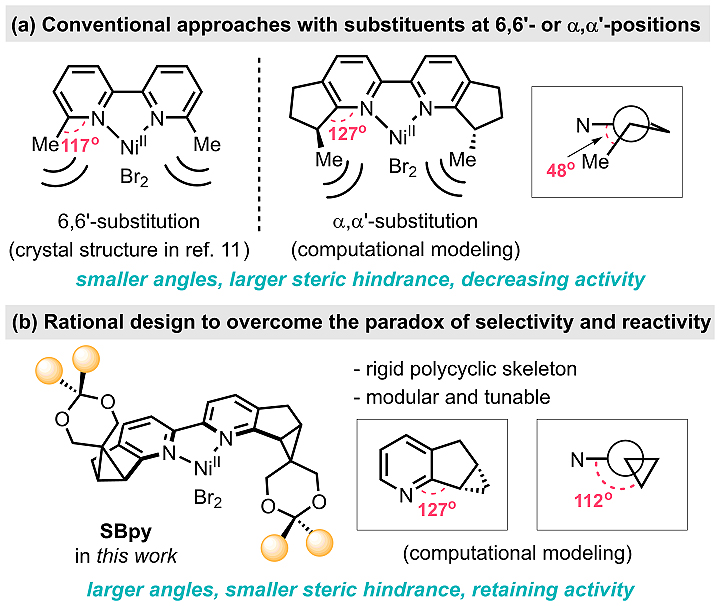
图3. 新骨架手性联吡啶配体的设计思路
为了验证SBpy配体的效果,作者选择药物合成中常见的羰基加成反应展开研究。目前,当量金属试剂对羰基的不对称加成已经较为成熟,但以易得的卤化物为原料实现这一转化则更具经济性和普适性。
作者以二苯甲酮衍生的手性联吡啶配体Ph-SBpy实现了分子间芳基卤化物对芳基醛的不对称还原加成反应。该反应催化活性高,条件温和,对大多数底物都取得了优秀的收率和对映选择性,并可应用于复杂药物的合成及衍生化(图4)。
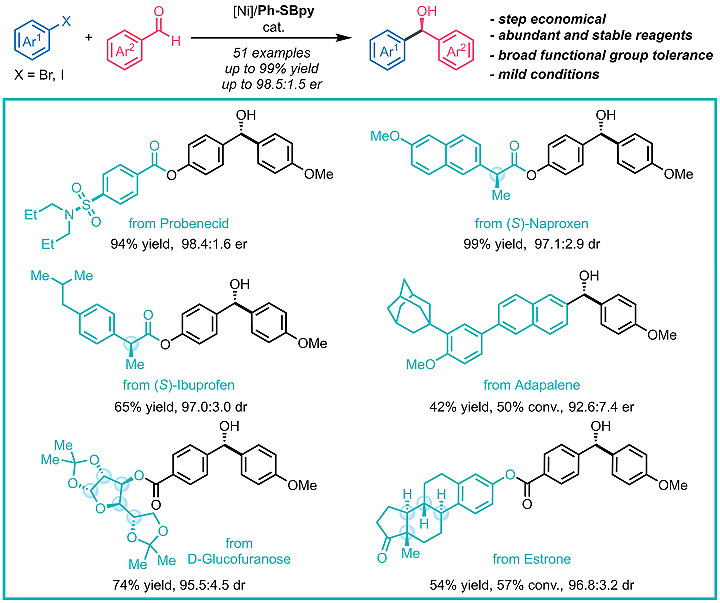
图4. Ph-SBpy促进的分子间不对称还原加成反应
作者进一步研究了配体结构与催化活性之间的关系。通过对一系列联吡啶配体进行比较,作者发现联吡啶上富电子取代基能显著提高催化活性,而近程位阻增大则会导致催化活性明显降低。在引入手性元素的同时,Ph-SBpy既具有富电子配体骨架,又使近程空间位阻最小化,还可通过侧链基团保证活性催化剂稳定性,因而即便在低温下仍然具有很高的催化活性。这些结果显示,SBpy配体可以“活性不打折”地实现反应的立体选择性。
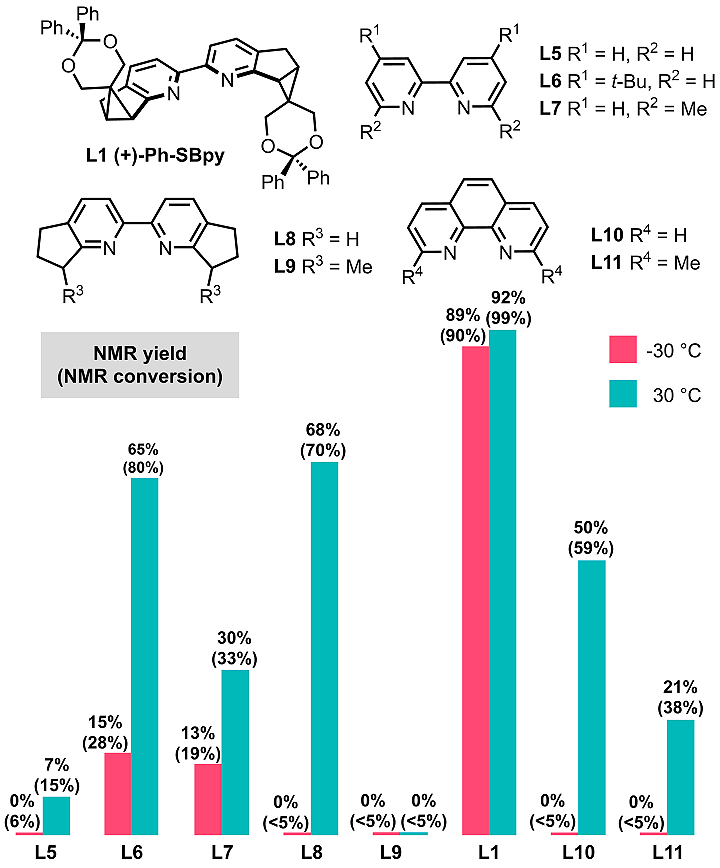
图5. Ph-Sbpy与其它联吡啶型配体的催化活性比较
作者通过机理实验提出镍催化芳基卤化物对醛不对称加成的可能机理。通过密度泛函理论计算,作者得到了立体选择性关键步骤的过渡态结构(图6)。在优势过渡态中,反应物苯甲醛的苯基和与临近的配体的苯基之间存在相互吸引的π–π堆积作用,进一步解释了Ph-SBpy比其他富电子、低位阻联吡啶配体活性更高的原因。
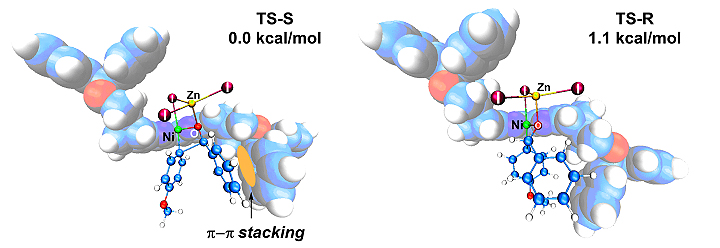
图6. Ph-Sbpy促进立体选择步骤的过渡态
总之,鉴于2,2’-联吡啶配体广泛的应用价值和之前手性版本的缺乏,李鹏飞课题组设计的结构可调新骨架手性联吡啶配体SBpy可望为相关不对称反应的发展及手性分子的选择性合成提供新工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Design and Synthesis of Tunable Chiral 2,2'-Bipyridine Ligands: Application to the Enantioselective Nickel-Catalyzed Reductive Arylation of Aldehydes
Shuai Zhang, Saima Perveen, Yizhao Ouyang, Liang Xu, Tao Yu, Min Zhao, Linghua Wang, Peidong Song, Pengfei Li
Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202117843
导师介绍
李鹏飞
https://www.x-mol.com/groups/lipengfei
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
























































 京公网安备 11010802027423号
京公网安备 11010802027423号