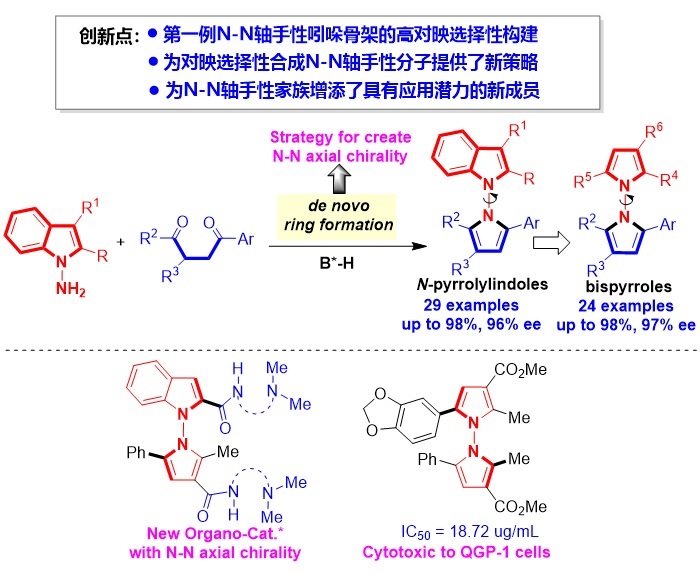
石枫课题组Angew:基于原位构环策略合成N-N轴手性吲哚和吡咯
导语:
轴手性分子广泛存在于天然产物、生物活性分子、手性催化剂及配体、功能材料中。因此,轴手性分子的催化不对称合成已经成为一个重要的研究领域。目前,已合成的轴手性分子主要集中于具有C-C轴或C-N轴的分子,且催化不对称合成这些分子的策略发展得比较充分。与之相比,具有N-N轴的手性分子的催化不对称合成却鲜有报道。近日,江苏师范大学石枫(点击查看介绍)课题组设计开发了N-氨基吲哚作为新型吲哚类平台分子,通过原位构环策略,实现了N-N轴手性吲哚和吡咯衍生物的高对映选择性合成,并探索了它们在不对称催化以及药物化学中的应用。该工作不仅为N-N轴手性分子的催化不对称合成提供了新策略,而且为N-N阻旋异构大家族增添了具有潜在应用价值的新成员。相关论文发表于Angew. Chem. Int. Ed.杂志。
轴手性分子,尤其是芳基轴手性分子,广泛存在于天然产物、生物活性分子、手性催化剂及配体、功能材料中。因此,轴手性分子的催化不对称合成已经成为一个重要的研究领域。目前,已合成的轴手性分子主要集中于具有C-C轴或C-N轴的分子(图1a)。例如,含有C-C轴的手性联芳基衍生物、芳基烯烃衍生物等,以及含有C-N轴的手性N-芳基吡咯衍生物、N-芳基酰胺衍生物等,而且这些分子的催化不对称合成策略发展得比较充分。与之相比,具有N-N轴的手性分子的催化不对称合成却鲜有报道。造成这一现象的原因是催化不对称合成N-N轴手性分子存在一些特定的挑战性问题,例如N-N轴手性分子的性质探究较少、该类轴手性分子的合成策略非常匮乏(图1b)。
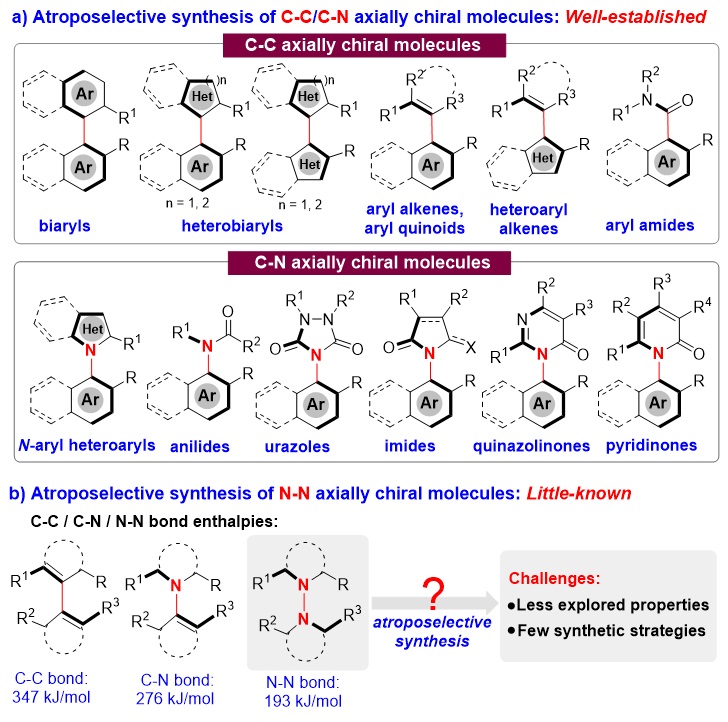
图1. 催化不对称合成轴手性化合物的概况及合成N-N轴手性化合物的挑战
直到最近,在该工作的研究过程中,化学工作者们才发展了两种催化不对称合成N-N轴手性分子的策略(图2)。第一种是新加坡国立大学卢一新课题组发展的不对称有机催化的动态动力学拆分策略(图2a, Chem 2021, 7, 2743),第二种是青岛大学刘人荣课题组发展的不对称金属催化的去对称化策略(图2b, J. Am. Chem. Soc. 2021, 143, 15005)。通过这些策略,实现了N-N轴手性1-氨基吡咯、3-氨基喹唑啉酮和双吡咯衍生物的对映选择性合成。此外,在该工作的投稿过程中,南开大学李鑫课题组也采用不对称有机催化的动态动力学拆分策略,实现了N-N轴手性3-氨基喹唑啉酮衍生物的对映选择性合成(Chem. Sci. 2022, 13, 141; Org. Lett. 2022, 24, 374)。尽管有了这些报道,该研究领域仍处于起步阶段,存在以下挑战性问题(图2c):(1)发展对映选择性合成N-N轴手性分子的新策略;(2)设计并合成新型的N-N轴手性分子;(3)发现N-N轴手性分子在合成化学和药物化学中的应用。所以,迫切需要开展相关研究,以解决这些挑战性问题。
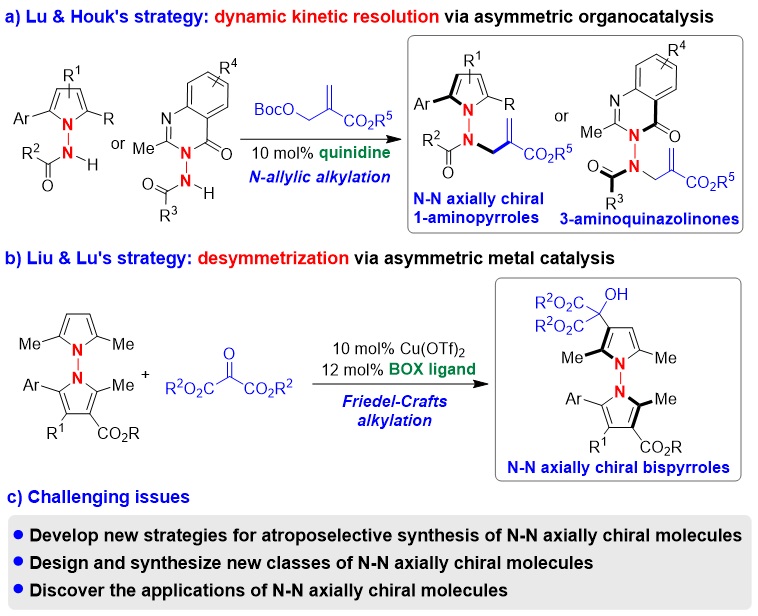
图2. 现有的对映选择性合成N-N轴手性分子的策略及存在的挑战性问题
为了解决上述挑战性问题,同时考虑到轴手性吲哚骨架在发现生物活性分子及开发手性催化剂方面的重要应用价值,石枫课题组希望设计一种新策略,以实现新型N-N轴手性吲哚骨架的催化不对称构建。如图3a所示,N-N轴手性吲哚骨架存在于一些具有生物活性的天然产物中,这显示N-N轴手性吲哚骨架的重要性及具有潜在的应用价值。近年来,催化不对称构建轴手性吲哚骨架已经成为一个新兴的研究领域(For a review: Chem. Eur. J. 2020, 26, 15779)。如图3b所示,目前已经实现了多种C-C及C-N轴手性吲哚骨架的高对映选择性构建。然而,化学工作者却一直没有实现N-N轴手性吲哚骨架的高对映选择性构建,这需要设计新颖的策略以实现该目标。

图3. N-N轴手性吲哚骨架的重要性及高对映选择性构建轴手性吲哚骨架的概况
为实现这个目标,石枫课题组基于设计新型的吲哚平台分子及其参与的催化不对称反应的研究策略(工作小结: Acc. Chem. Res. 2020, 53, 425; 近期代表性工作: Fund. Res. 2022, DOI: 10.1016/j.fmre.2022.01.002; Angew. Chem. Int. Ed. 2021, 60, 2355; Chin. J. Chem. 2020, 38, 543),设计开发了N-氨基吲哚作为新型的吲哚平台分子,通过原位构环的策略,实现了N-N轴手性吲哚骨架的高对映选择性构建。
作者设计N-氨基吲哚平台分子的思路是(图4a):在吲哚C2位引入大位阻R基团,以增加N-N轴的旋转能垒,增强N-N轴手性分子的稳定性;在吲哚N1位引入氨基这一关键官能团,为原位构环策略提供反应位点和有机催化的活化位点。这些结构特点能够确保N-氨基吲哚在有机催化下发生不对称环化反应,通过原位构环的新策略,实现N-N轴手性吲哚骨架的高对映选择性构建。但是,在采用该策略的过程中,主要有三个问题需要解决:(1)合成邻位带有大位阻基团的高活性N-氨基吲哚;(2)寻找合适的环化反应以实现原位构环;(3)采用合适的有机催化剂以控制N-N轴手性。
为了解决这些问题,作者设计了手性磷酸催化下N-氨基吲哚与芳基取代的1,4-二酮的不对称Paal-Knorr反应(图4b)。采用Paal-Knorr反应作为合适的环化反应以实现原位构环,是基于N-氨基吲哚中氨基的反应性以及Paal-Knorr反应在构建吡咯环中的优势。选择手性磷酸作为高效的有机催化剂,是由于手性磷酸有可能与两种反应物的氨基和羰基形成氢键,从而控制N-N轴手性。由于N-N轴两侧大位阻的R基团和Ar基团的空间位阻,该反应将实现N-吡咯吲哚衍生物的高对映选择性合成。
因此,该工作将不仅实现第一例N-N轴手性吲哚骨架的高对映选择性构建,而且为对映选择性合成N-N轴手性分子提供新策略,同时为N-N轴手性家族增添具有潜在应用价值的新成员。
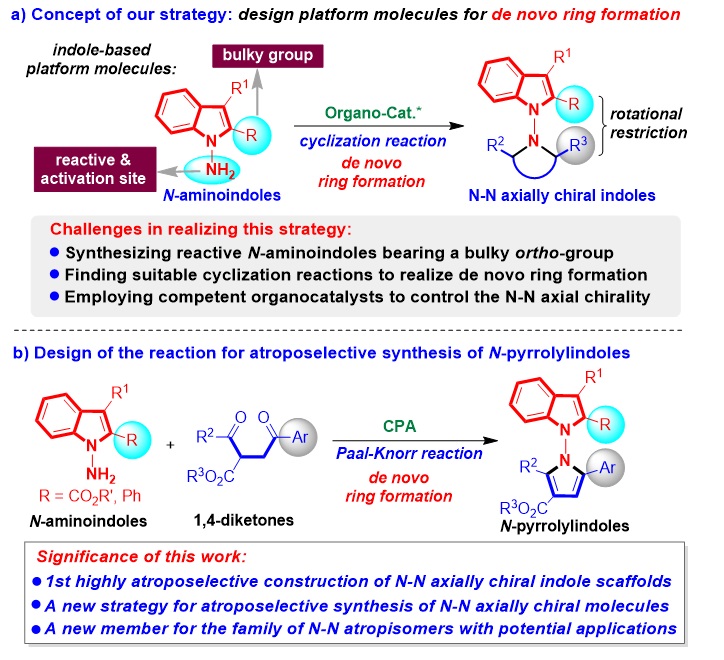
图4. 对映选择性合成N-N轴手性吲哚衍生物的新策略
基于上述策略,作者采用N-氨基吲哚1a与1,4-二酮化合物2a作为反应物,进行反应条件优化,最终以93%的产率和94% ee得到N-N轴手性吲哚-吡咯衍生物3aa(图5)。
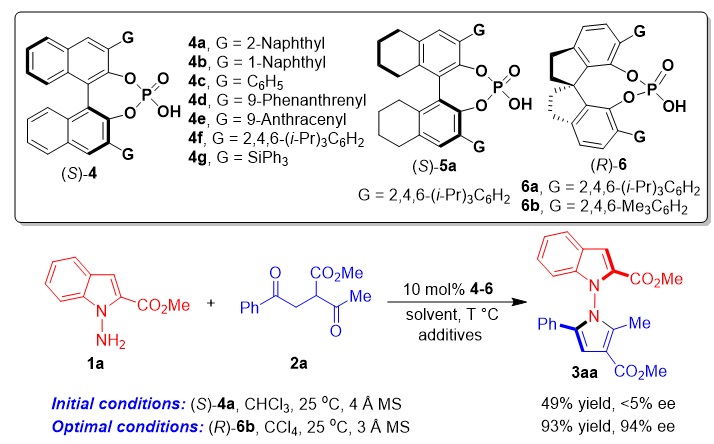
图5. 合成N-N轴手性吲哚-吡咯衍生物的反应条件优化
确定了反应的最优条件之后,作者考察了底物的适用范围,发现含不同取代基的N-氨基吲哚1及1,4-二酮2都能适用于该反应,可以高收率、高对映选择性地得到结构复杂多样的N-N轴手性吲哚-吡咯化合物3(图6)。
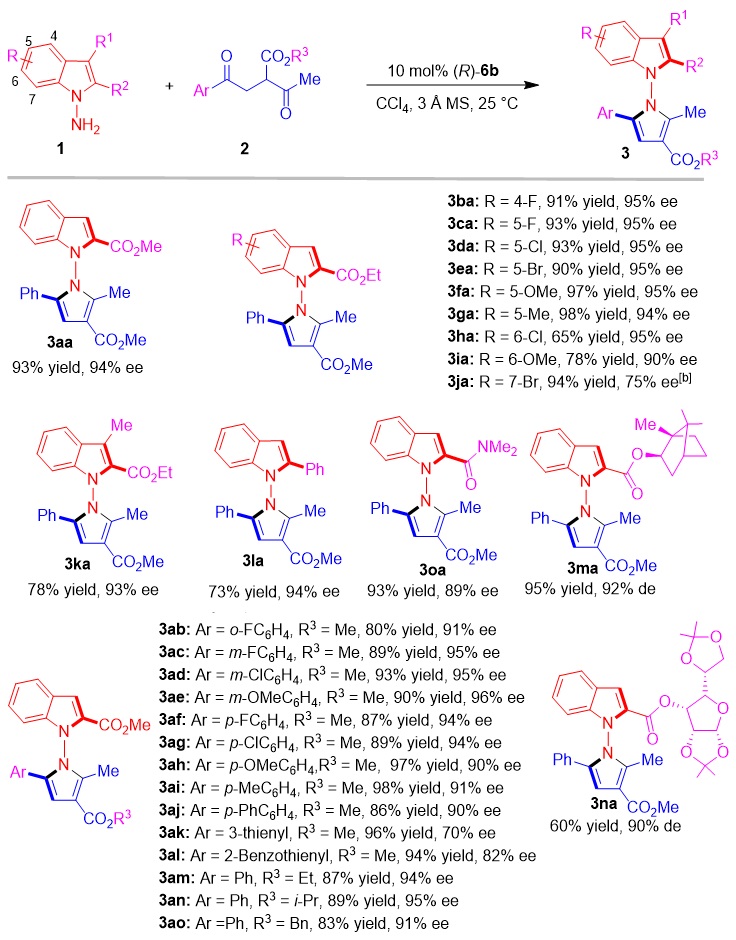
图6. 合成N-N轴手性吲哚-吡咯衍生物的底物适用范围
为了探究该策略在合成 N-N轴手性分子中的普适性,作者进一步使用N-氨基吡咯7a作为底物与1,4-二酮2a进行反应,经过反应条件优化,最终以92%的产率和96% ee得到N-N轴手性双吡咯衍生物8aa(图7),由此说明该策略在对映选择性合成N-N轴手性分子中具有较宽的适用范围。
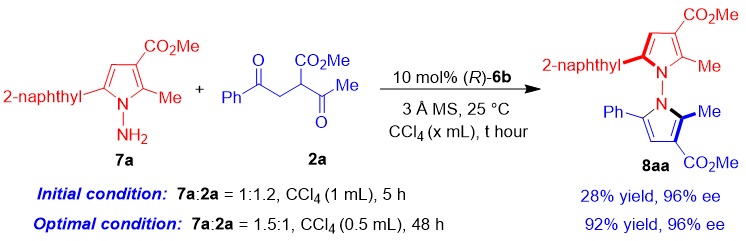
图7. 合成N-N轴手性双吡咯衍生物的反应条件优化
通过对底物兼容性的研究,发现带有不同取代基的N-氨基吡咯7及1,4-二酮2都能适用于该反应,高对映选择性地得到N-N轴手性双吡咯衍生物(图8)。

图8. 合成N-N轴手性双吡咯衍生物的底物适用范围
为了进一步了解这两类新型N-N轴手性杂环骨架的性质,作者探究了该类轴手性骨架的稳定性和旋转能垒(图9)。实验结果显示,产物3aa及8ag在110 ℃下搅拌12小时后,能够以接近定量的收率回收,并且对映选择性能保持不变(图9a),这表明该类轴手性骨架具有高的化学稳定性和构型稳定性。此外,计算发现,3aa和8ag具有很高的旋转能垒(图9b)。这两类N-N轴手性杂环骨架具有高的稳定性和高的旋转能垒,可能是由于轴两侧存在邻位大基团的原因。
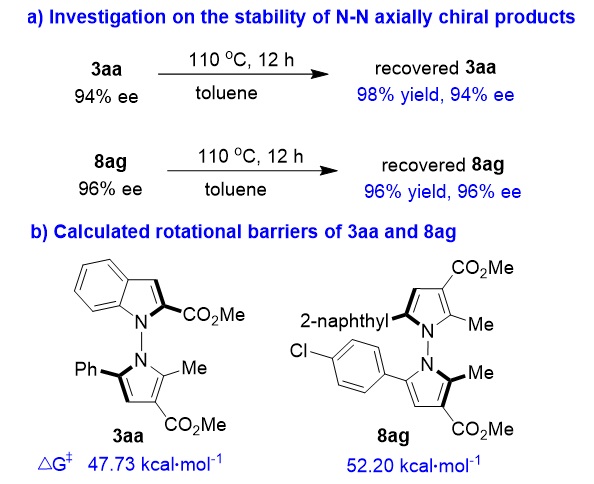
图9. 探究N-N轴手性杂环骨架的稳定性及旋转能垒
根据实验结果,作者推测了可能的反应机理及催化剂的活化模式(图10)。首先,在手性磷酸催化下,N-氨基吲哚和1,4-二酮脱水缩合,形成亚胺中间体A,接着异构化成烯胺中间体B。随后,在手性磷酸作用下,发生分子内环化生成中间体C,该中间体脱水后,生成N-N轴手性吲哚-吡咯衍生物。
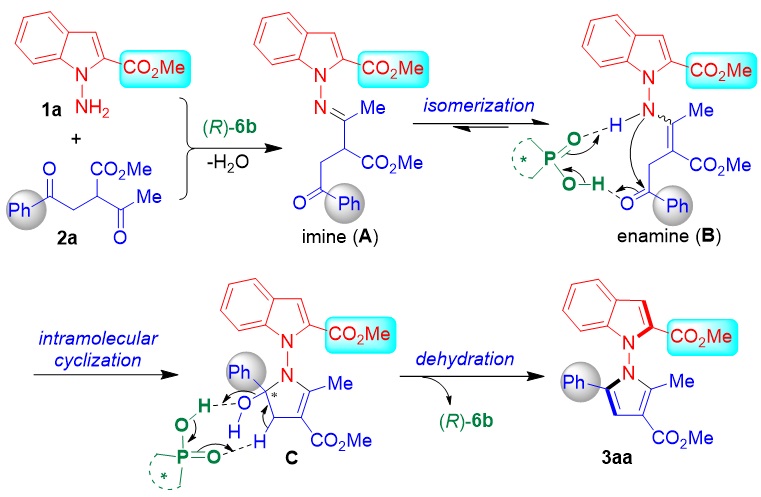
图10. 可能的反应途径
为了研究反应的实用性和产物的用途(图11),作者进行了产物3aa和8aa的放大量实验以及衍生化实验,均获得了优良的收率,对映选择性也均能保持。这些衍生化实验说明这两类产物3和8可以转化为带有不同官能团的N-N轴手性分子。
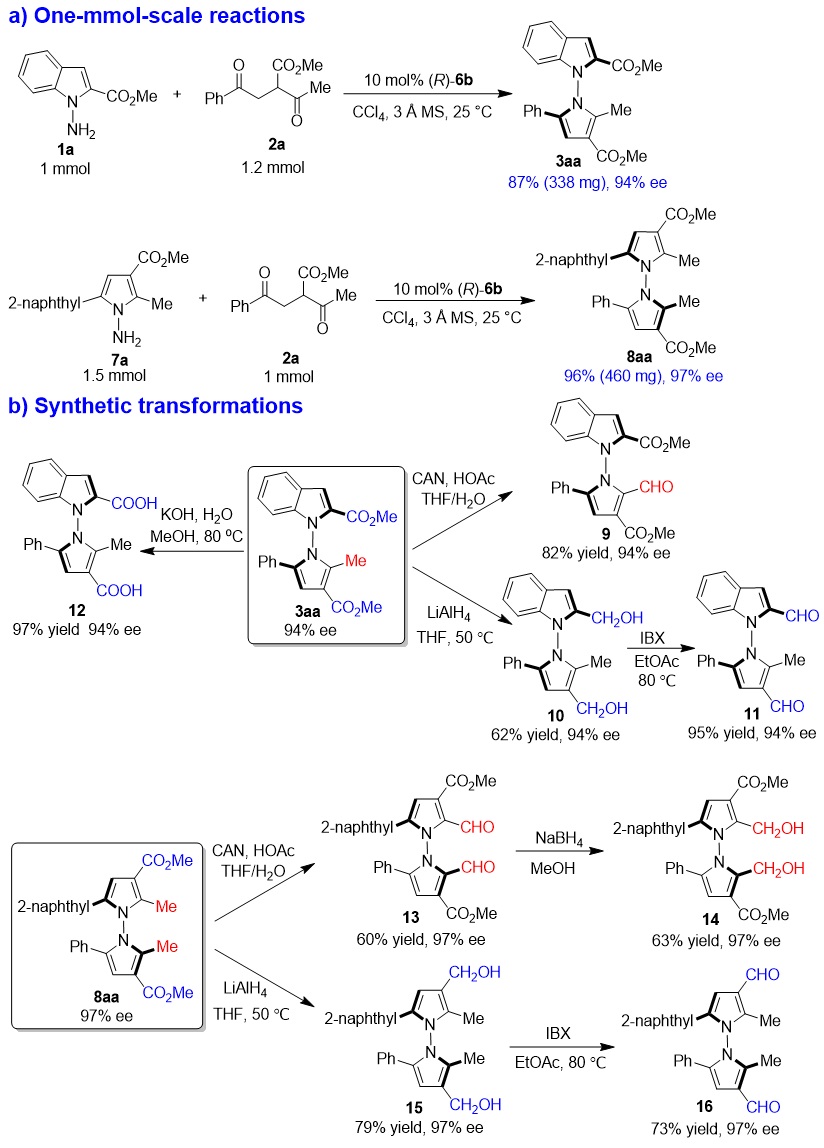
图11. 放大量实验以及产物的衍生化实验
为了探索这两类轴手性骨架在不对称催化中的应用价值,作者将衍生化产物12转化成了新型的N-N轴手性叔胺-酰胺催化剂(Cat.1、Cat.3)以及兼具N-N轴手性及中心手性的叔胺-酰胺催化剂(Cat.2),并将其应用于噻唑亚胺17与高肽酸酐18的催化不对称(2+4)环化反应(图12),获得了中等至优异的对映选择性。这些结果表明,该类新型的有机小分子催化剂在不对称催化中有望得到更广阔的应用。
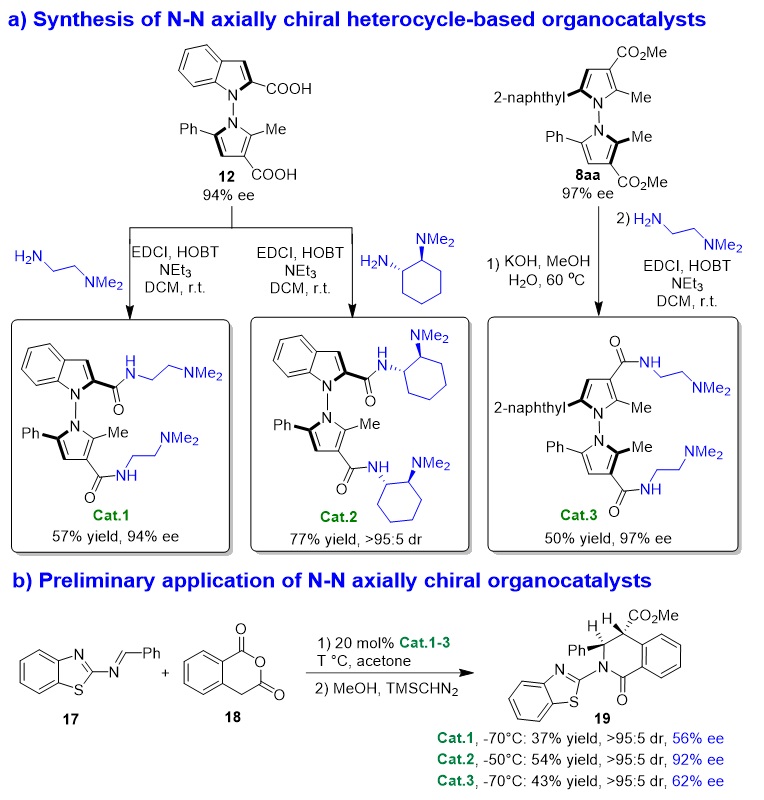
图12. N-N轴手性有机小分子催化剂的合成及应用
最后,为了探究该类新型N-N轴手性杂环分子可能的生物活性,作者对部分产物进行了抗肿瘤活性筛选,发现一些化合物对QGP-1肿瘤细胞具有较好的细胞毒活性(图13)。
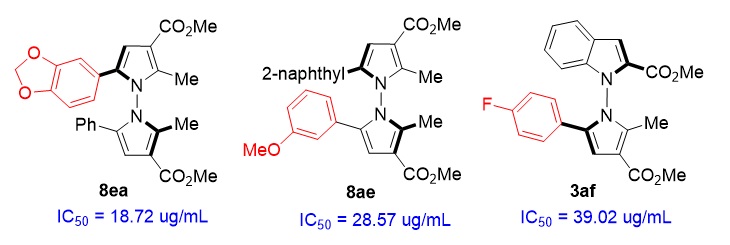
图13. 具有较好抗肿瘤活性的N-N轴手性分子
综上所述,石枫课题组采用原位构环的新策略,实现了N-N轴手性吲哚和吡咯衍生物的高对映选择性合成,并且将合成的N-N轴手性杂环分子转化成手性催化剂,应用于催化不对称合成中。此外,还发现了一些具有较好抗肿瘤活性的N-N轴手性杂环分子。该工作不仅为N-N轴手性分子的催化不对称合成提供了新策略,而且为N-N阻旋异构大家族增添了新成员,有望应用于合成化学和药物化学领域。
上述研究成果发表在Angew. Chem. Int. Ed.上,江苏师范大学硕士研究生陈科伟和陈志寒为共同第一作者,石枫教授和张宇辰副教授为共同通讯作者,该项工作主要得到了国家自然科学基金和江苏省自然科学基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Organocatalytic Atroposelective Synthesis of N–N Axially Chiral Indoles and Pyrroles by De Novo Ring Formation
Ke-Wei Chen, Zhi-Han Chen, Shuang Yang, Shu-Fang Wu, Yu-Chen Zhang, Feng Shi
Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202116829
通讯作者简介

石枫 教授
石枫,江苏师范大学化学与材料科学学院教授。1998年和2004年于江苏师范大学分别获得学士和硕士学位,2010年至2013年攻读了苏州大学与中国科学技术大学联合培养的博士学位,2012年至2013年赴新加坡南洋理工大学从事访问学者工作。先后获得国家杰出青年科学基金(2021)、江苏省杰出青年基金(2016)、江苏省“六大人才高峰”高层次人才、江苏省“333高层次人才”中青年学术技术带头人、江苏省高校“青蓝工程”中青年学术带头人等人才项目。主要从事催化不对称合成手性杂环分子的研究,聚焦手性吲哚化学这一研究领域,为构建结构复杂多样的手性生物活性杂环骨架(尤其手性吲哚化合物)提供了高效、高选择性的方法。以通讯作者在《Acc. Chem. Res.》、《Fund. Res.》、《J. Am. Chem. Soc.》、《Angew. Chem. Int. Ed.》、《Chin. J. Chem.》、《ACS Catal.》、《Org. Lett.》、《Chem. Commun.》、《Adv. Synth. Catal.》、《J. Org. Chem.》等业界公认的国际重要科技期刊发表学术论文120余篇,入选Elsevier 2020高被引学者。荣获江苏省第二届“十佳研究生导师”提名奖、江苏省研究生教育改革成果奖优秀奖、江苏省科学技术二等奖、教育部自然科学二等奖、Thieme Chemistry Journal Award、Asian Core Program Lectureship Award、新和成《中国化学》创新奖等奖项。担任《有机化学》、《Chem. Synth.》青年编委、《Org. Chem. Front.》《J. Org. Chem.》和《Eur. J. Org. Chem.》国际编委。
石枫课题组主页:
https://www.x-mol.com/groups/Shi_Feng

张宇辰 副教授
张宇辰,江苏师范大学化学与材料科学学院副教授。2016年于江苏师范大学获得硕士学位(导师:石枫教授、王树良教授),2019年于中国科学技术大学获得博士学位(导师:龚流柱教授),同年被引进到江苏师范大学。主要从事手性生物活性骨架的催化不对称构建方面的研究,近年来以第一作者或通讯作者在《Acc. Chem. Res.》、《J. Am. Chem. Soc.》《Angew. Chem. Int. Ed.》、《Chin. J. Chem.》、《Org. Chem. Front.》、《Org. Lett.》等业界公认的国际重要科技期刊发表学术论文10余篇。
石枫课题组简介

石枫课题组成立于2013年,课题组指导教师目前包括石枫教授(中间)、张宇辰副教授(左一)、谭伟副教授(右一),课题组学生包括硕士研究生和本科生。课题组对学生的培养理念是“英雄不论出身”,努力把每一个学生都培养成优秀的学生、同龄人中的佼佼者,不放弃任何一个学生。课题组培养的硕士研究生中,有13人获得研究生国家奖学金,有16人以第一作者在业界公认的国际重要科技期刊《Fund. Res.》《J. Am. Chem. Soc.》《Angew. Chem. Int. Ed.》《Chin. J. Chem.》发表高质量学术论文18篇,1人获得“江苏省三好学生”荣誉称号,有90%以上通过“申请-考核制”进入名校继续攻读博士学位。
石枫课题组长期致力于催化不对称构建生物活性手性杂环骨架,尤其是含有吲哚母核的手性杂环骨架。通过设计和开发新型的吲哚平台分子及其参与的催化不对称反应,为构建手性吲哚类杂环骨架提供了高效、高立体选择性的方法,促进了手性吲哚化学的发展(工作总结:Acc. Chem. Res. 2020, 53, 425)。课题组不仅在催化不对称构建中心手性吲哚类杂环骨架领域取得了标志性成果(代表性工作:Angew. Chem. Int. Ed. 2014, 53, 13912; Angew. Chem. Int. Ed. 2015, 54, 5460; ACS Catal. 2017, 7, 6984; Angew. Chem. Int. Ed. 2018, 57, 5398; Angew. Chem. Int. Ed. 2019, 58, 8703; Angew. Chem. Int. Ed. 2021, 60, 2355),而且在催化不对称构建轴手性吲哚骨架及其应用领域取得了创新性成果(代表性工作:Angew. Chem. Int. Ed. 2017, 56, 116; Angew. Chem. Int. Ed. 2019, 58, 3014; Angew. Chem. Int. Ed. 2019, 58, 15104; Chin. J. Chem. 2020, 38, 543; J. Am. Chem. Soc. 2020, 142, 15686; Chin. J. Chem. 2021, 39, 2163; Angew. Chem. Int. Ed. 2022, 10.1002/anie.202112226; Angew. Chem. Int. Ed. 2022, 10.1002/anie.202116829; Fund. Res. 2022, 10.1016/j.fmre.2022.01.002),促进了该领域的发展(综述:Chem. Eur. J. 2020, 26, 15779)。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号