余金权、叶萌春等人Nat. Chem.:Ni-Al双金属大环催化吡啶C3-H键烯基化反应
众所周知,C-H键是自然界中最常见的化学键,几乎所有的有机化合物中都含有C-H键。然而,由于C-H键的键能非常高且碳元素与氢元素的电负性很接近,因此C-H键的极性较小并且具有很强的惰性,致使在温和条件下实现C-H键的位点选择性活化具有很大的挑战。2012年,余金权课题组首次利用具有环蕃拓扑结构的过渡态实现了远程C-H键位点选择性活化。其导向的方法类似于酶通过和底物弱相互作用的远程定位活化。目前,主要使用的有效策略是共价锚定模板(I型,图1a),但是该方法需要化学计量的试剂和额外的模板连接与去除步骤。为了克服这一限制,化学家开发了一种可逆锚定模板策略(II型,图1a),并将其用于Ir催化的远程C-H键活化的选择性硼化反应。但该策略难以应用于C-C键的构建反应,因为这类反应往往活性较低,且常常需要较为剧烈的反应条件。直到2017年,余金权课题组报道了第一例通过 Pd-Pd 同型双金属可逆配位的远程活化C-H键以构建C-C键的反应(Nature, 2017, 543, 538, 点击阅读详细; Nat. Chem., 2020, 12, 399, 点击阅读详细,图1b)。尽管如此,但该方法仍存在显著的局限性,如钯、配体等用量较高以及需要化学计量的贵金属氧化剂。实现用其他更廉价的金属组装环蕃过渡态来进行远程碳氢键活化反应是一个巨大的挑战。
尽管C3-烯丙基化吡啶广泛存在于生物活性分子中(图1c),但是由于吡啶强的σ-配位能力通常会使金属催化剂中毒,同时吡啶环的缺电性致使常用的亲电活化机理难以进行,因此吡啶C-H键位点选择性的高效活化方法仍然较为少见,特别是相对最难活化的吡啶C3-H键。2011年,余金权教授发现强配位的双齿配体可以防止Pd中心与吡啶配位,从而实现吡啶的直接 C3-H 键烯基化(图1d),但是该方法通过亲电活化机理进行,由于吡啶环的缺电性,反应活性较低,需要大大过量的吡啶底物和较高的底物浓度才能获得合适的活性,不仅导致反应原子经济性低,而且无法应用于具有生物活性的复杂吡啶衍生物。为了解决这一挑战,实现限量吡啶的C3-H直接烯基化,美国斯克里普斯研究所(The Scripps Research Institute,TSRI)的余金权教授与南开大学的叶萌春研究员设想利用氧化加成策略来进行尝试,因为已有的氧化加成途径活化吡啶都可以实现限量反应。但是该策略面临一个最大的挑战是,低价金属Ni和C-H的氧化加成途径更易于发生在更缺电子C2和C4位(图1e)。为此,作者设想引入合适的桥联配体,利用位阻和张力效应组装能垒最低的环蕃过渡态,从而实现一当量吡啶的C3-H的选择性活化。在此思路下,作者设计开发了一种双功能NHC配体连接的Ni-Al异核双金属催化剂(类似于酶的远程定向活化),实现了缺电子吡啶的C3-H键烯基化(图1f),以43-99% 的产率和高达98:2的C3选择性制备了一系列烯基化吡啶,并为含氮杂环的生物活性分子的后期修饰开辟了新的途径。相关工作于近日发表在Nature Chemistry 上。
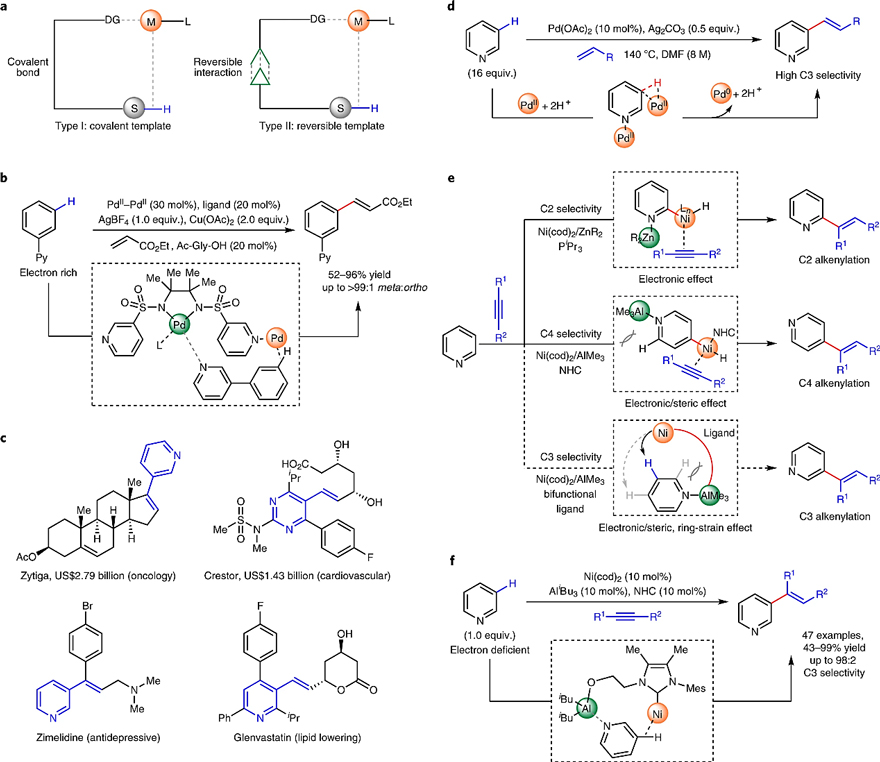
图1. 远程 C-H键活化策略。图片来源:Nat. Chem.
首先,作者选择吡啶1a与4-辛炔2a为模板底物对反应条件进行优化(图2),初步结果表明传统的膦配体和NHC配体的反应性较差,得到的主要是C2与C4位烯基化产物。有意思的是,当使用配体L1时,能以适中的收率(33%)提供C3位单烯基化产物,这一结果表明双功能NHC配体可以通过环张力的调节克服吡啶的空间效应和电子效应。鉴于配体和底物之间的相互作用可能依赖于配位原子的性质以及所用配体骨架的结构,因此作者考查了一系列含Al Lewis酸,并改变配体侧臂连接体的长度。研究发现,当使用AliBu3作为Lewis酸助催化剂与配体L1结合时,能以83:17的选择性以及63%的收率获得C3位烯基化吡啶。进一步的配体筛选表明咪唑环(L5-L8)的电子调节是非常关键的因素,而在苯环邻位上的空间修饰和配体侧臂上长度的增加(L2-L4)却是无效的。另外,对苯环电性(L9-L11)的进一步研究表明对甲氧基取代的苯环(L10)效果最优,能以87%的收率和93:7的选择性得到目标产物3a。最为重要的是,O-甲基化配体L12未发生反应,这说明含羟基侧臂对反应活性和选择性都至关重要。
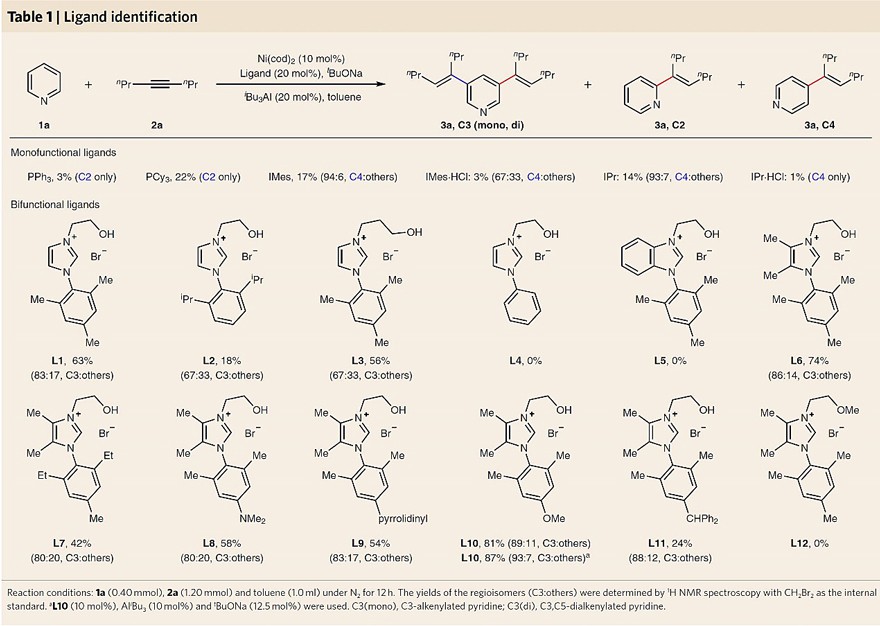
图2. 配体筛选。图片来源:Nat. Chem.
在最优条件下,作者考察了吡啶和其它氮杂芳烃的底物范围(图3),结果显示C3位带有供电子基团『如:烷基(3b-3d)、烷氧基(3e)、氨基(3f-3g)』的吡啶底物均能兼容该反应,以49-64%的收率和93:7-97:3的C5选择性得到所需产物。此外,C3位的吸电子基团『如:F(3h)和CF3(3i)』可以降低吡啶环上的电子密度,从而促进 C-H键与Ni(0)催化剂的氧化加成,因此显著提高了反应产率(91-99%)。然而,强吸电子性会导致吡啶基团与Lewis酸之间的结合较差,因此3i的C5选择性降低。值得一提的是,该反应还能耐受多种官能团,例如:酯基(3j)、酰胺(3k)、苯基(3l)、2-萘基(3m)、4-OMe苯基(3n)、4-TMS苯基(3o)、4-BPin苯基(3p)。由于给电子效应和空间位阻的原因,导致C4-苯基取代底物(3q)的反应活性和选择性都降低。然而,较小的 C4-F取代底物(3r)的反应活性与选择性却很高。此外,C2取代基的存在使得反应活性和选择性较差(3s和3t)。值得注意的是,其它氮杂芳烃『如:哒嗪(3u)、嘧啶(3v、3w)、喹啉(3x)』同样能实现这一转化,但由于喹啉与Lewis酸配位能力较差,因此3x 的C3选择性较差(50:50)。
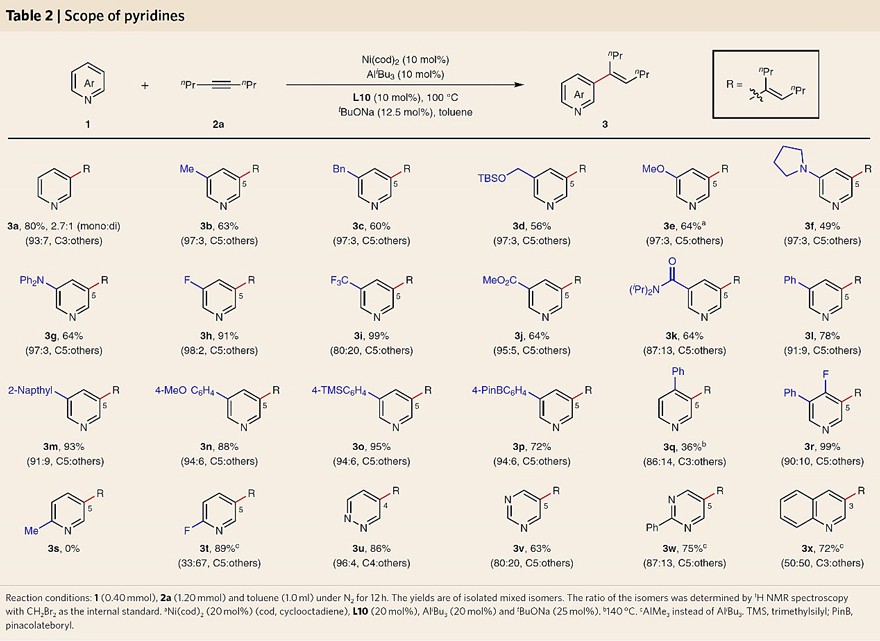
图3. 吡啶底物拓展。图片来源:Nat. Chem.
接下来,作者以3-氟吡啶(1h)为模型底物对炔烃的底物范围进行了考察。如图4所示,对称二烷基炔(4a-4e)、非对称烷基炔(4f-4i, 4n和4o)甚至含有潜在酸以及对Lewis酸敏感的烷基炔『如硅烷(4i、4j)、硅基醚(4k-4o)』都能兼容该反应,以中等至优异的产率和良好的C5选择性获得三取代烯基化产物。需要指出的是,非对称炔烃的区域选择性会受两个炔烃取代基之间的相对空间位阻控制,因此尺寸差异越大,烯烃的区域选择性越高(例如:4g-4i、4n和4o的区域异构体比例≥20:1)。另外,该方法还能实现含氮杂环生物活性分子的后期修饰。如图5所示,一系列烟酸衍生的复杂分子『如:(-)-薄荷醇(5a)、(-)-冰片(5b)、双丙酮果糖(5c)、(-)-Corey内酯二醇(5d)和胆固醇(5e)』、药物相关的化合物『如:中枢神经系统活性剂(5f)、抗癌药阿比特龙(5g)』以及生物活性类固醇激素『如:雌酮(5h)和雌二醇(5i)』均能实现这一转化,以43-89%的产率和91:9-97:3的C5选择性获得相应的烯基化产物。毫无疑问,这种远程位点选择性策略对于实现有机分子的分子编辑至关重要。
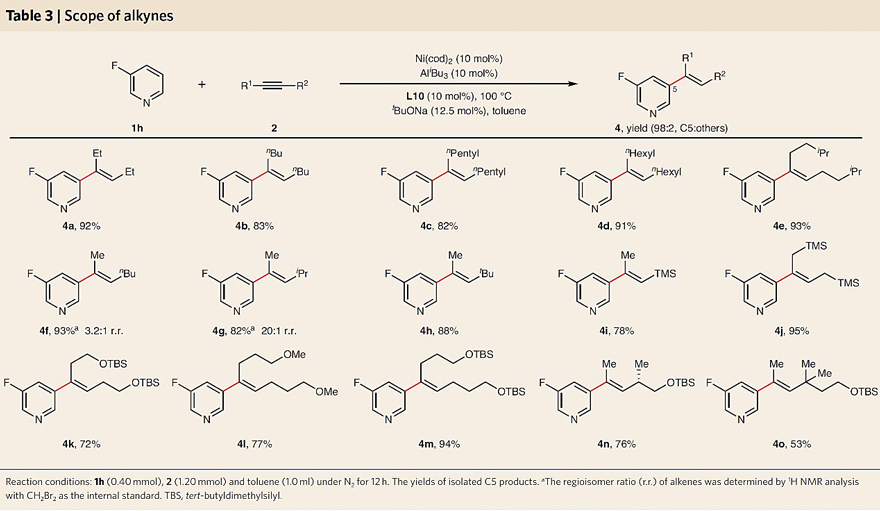
图4. 炔烃底物拓展。图片来源:Nat. Chem.
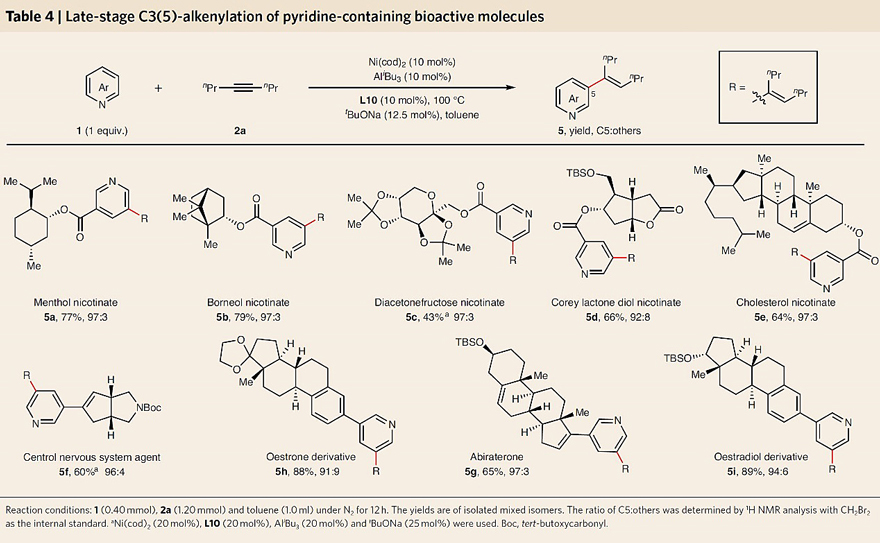
图5. 活性分子的后期修饰。图片来源:Nat. Chem.
为了探究反应机理,作者进行了进一步研究:1)底物1l和d-1l的分子间竞争实验和平行实验均未产生显著的动力学同位素效应(KIE = 1.2,图6a),这表明C3-H键的活化不是决速步;2)化学计量的1H NMR实验表明,3-苯基吡啶与AlMe3混合后获得了配合物A,后者可与配体L10去质子化获得配合物B,并且 B中3-苯基吡啶上H2、H3和H6的化学位移明显向低场移动(图6b);3)三组分配合物B可直接催化3-苯基吡啶的C3-烯基化反应,以34%的产率获得相应产物3l(图6c),这表明三元配合物B具有催化的能力,可能是反应的关键中间体。基于上述实验结果,作者提出了一种合理的反应机理(图6d)。首先,吡啶1a、双功能NHC配体、镍和铝物种组合形成四组分配合物(I),后者通过氧化加成进行C-H键活化,接着经炔烃插入生成中间体(II)。随后,中间体(II)发生还原消除与配体交换完成催化循环。值得注意的是,吡啶在C3-H键上的选择性活化归因于大环过渡态空间位阻和环张力的组合,这类似于酶的远程定位,从而促使Ni催化剂优先活化C3-H键,取代了低价镍催化C-H键活化中常见的C2/C4选择性。
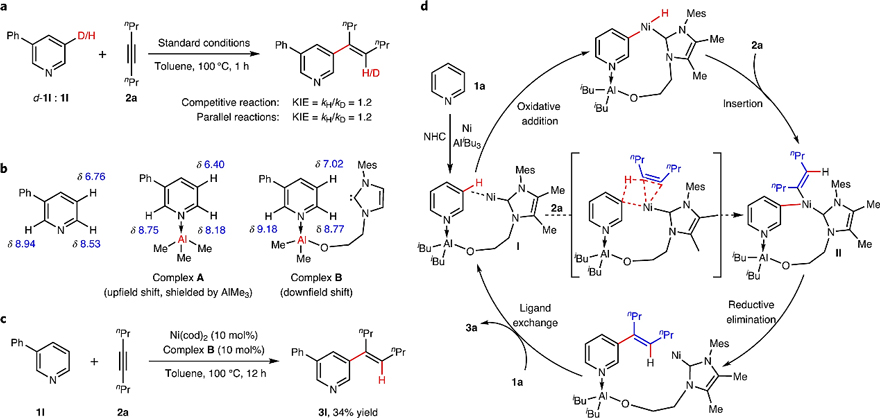
图6. 反应机理研究。图片来源:Nat. Chem.
总结
余金权教授与叶萌春研究员等人开发了一种双功能Ni催化剂,以43-99%的收率和优异的C3选择性(高达98:2)获得了一系列吡啶C3(5)-烯基化产物。该方法不仅避免了使用化学计量的金属氧化剂,使一系列简单吡啶和氮杂芳烃的烯基化成为可能,而且还能与复杂吡啶骨架兼容,为含氮杂环的生物活性分子的后期修饰开辟了新的途径。此外,该催化体系为解决基于C-H键位点选择性活化的C-C键形成提供了一个有前景的解决方案,或许在不久的将来这一策略能够应用于更广泛的催化体系,为有机分子的分子编辑提供一条有效途径。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A directive Ni catalyst overrides conventional site selectivity in pyridine C–H alkenylation
Tao Zhang, Yu-Xin Luan, Nelson Y. S. Lam, Jiang-Fei Li, Yue Li, Mengchun Ye, Jin-Quan Yu
Nat. Chem., 2021. DOI: 10.1038/s41557-021-00792-1
(本稿件由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!










































 京公网安备 11010802027423号
京公网安备 11010802027423号