JACS Au:酶-配体体系超快结构动力学及其生化相关性的太赫兹谱学理论研究
随着生命科学与化学物理表征技术两方面的高速发展,生物体系中的皮秒尺度超快动力学过程以及它们与生命过程的联系这一交叉科学问题越来越受到人们的关注。例如酶蛋白-配体体系中特定的亚皮秒-皮秒尺度集合运动被认为能够引导体系在高度复杂的反应势能面上转变,由此促进特定的酶化学反应和生物过程。然而由于探测工具的缺乏,对这些超快酶运动的实验报道极为稀少。关于它们的分子细节以及与酶生化活动的关联性的知识也极度缺失。
由于太赫兹频率窗口与皮秒时间窗口通过傅里叶变换直接关联,太赫兹光学科尔效应 (OKE) 谱学技术具有直接探测生物体系超快结构动力学过程的优良潜力。OKE还避免了其它太赫兹技术中水吸收谱峰或瑞利散射谱峰过强导致的问题。然而由于定量破译复杂溶液体系OKE信号非常困难,该技术在生物分子体系中的应用仍受到极大制约。
与在许多其它当代谱学研究中一样,理论模拟对突破这一限制能起到至关重要的作用。但因为缺乏统一的可极化分子相互作用模型来同时描述复杂生物大分子溶液体系构象涨落和在光谱精度上精确计算体系极化率,溶液中生物分子体系的OKE光谱被认为迄今为止无法被精确模拟。
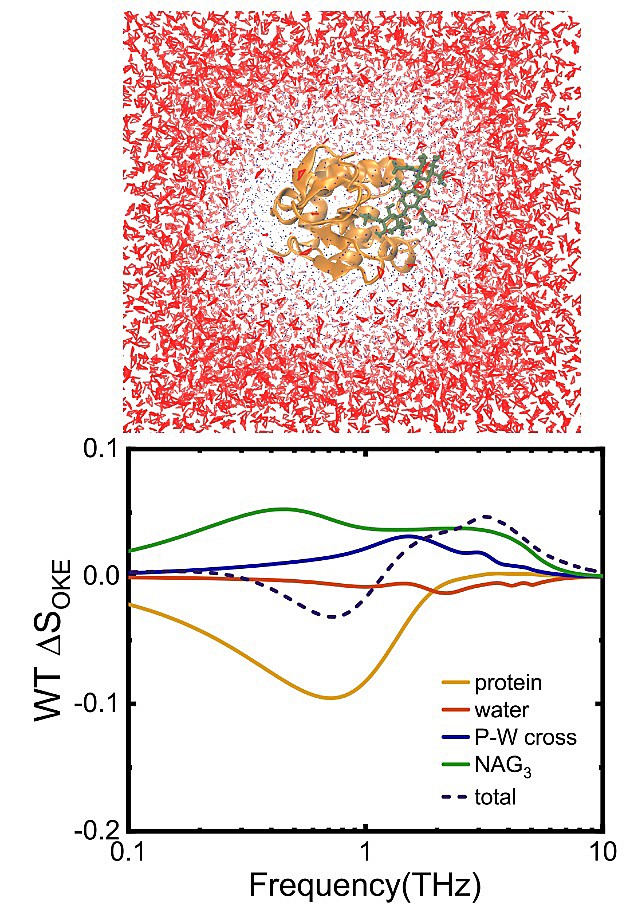
图1. 溶液中的lysozyme-NAG3结合体(上图),模拟的该体系OKE差谱信号(下图虚线)以及拆分所得信号中来自体系各部分的贡献(下图实线)。
近日,中科院福建物构所庄巍课题组与西湖大学黄晶课题组合作,首次基于Drude/MPID统一可极化分子相互作用模型对水溶液中溶解酶蛋白(lysozyme)-三乙酰壳三糖(NAG3)配体结合体系的太赫兹OKE光谱,及其与酶蛋白-水(无配体)体系信号的差谱进行了精确模拟,并通过拆分差谱信号定量确认了其中酶蛋白、水和配体各自的贡献。进一步的分析表明差谱信号中蛋白的贡献主要来自高极性的芳香残基的结构动力学涨落在配体插入前后的微妙差别。而水的贡献则主要来自配体与蛋白内壁共同锁住的受限水的转动。通过对蛋白突变体(mutant)类似信号的模拟分析及与野生类型(wildtype)信号的比较,本工作揭示了OKE信号对酶-配体结合情况微小变化的高度敏感性 (以往的工作表明圆二色谱和荧光谱等常用技术对这一变化并不敏感)。另外,通过将差谱信号与一个包含不关联的蛋白与配体部分的假想体系信号进行对比,本工作也揭示了单纯的蛋白-配体结合活动本身在OKE信号中的显著响应。
综上所述,这一工作首次基于统一的可极化分子相互作用模型对复杂生物分子体系的太赫兹科尔效应光谱进行了精确模拟,基于此系统地揭示了太赫兹OKE技术在复杂生物分子体系皮秒尺度结构动力学过程及其生化相关性研究中的潜力,以及理论模拟能够起到的重要作用。上述研究成果发表在JACS Au。福建物构所庄巍、西湖大学黄晶为本文的共同通讯作者,福建物构所潘志君博士(现任职深圳湾实验室)为本文第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Protein–Ligand Binding Molecular Details Revealed by Terahertz Optical Kerr Spectroscopy: A Simulation Study
Zhijun Pan, Jing Huang*, and Wei Zhuang*
JACS Au, 2021, DOI: 10.1021/jacsau.1c00356
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号