北大王剑波团队Nature Chem.:高对映选择性硫叶立德[2,3]-sigma重排
向分子中引入含氟基团可以大大改变有机小分子的物理、化学性质和生理活性,特别是可以提高小分子的脂溶性,因而在药物化学中有非常广泛的应用。在常见的含氟官能团中,三氟甲硫基(SCF3)由于具有独特的电子性能、高稳定性以及高亲脂性,在药物设计及研发中的重要性日益增加。近年来,如何高效地在药物分子的合适位置引入三氟甲硫基受到了有机化学家们的关注。虽然三氟甲硫化的相关合成方法学已经取得了重要进展,但如何对映选择性地引入三氟甲硫基依然存在着诸多挑战。
近日,北京大学化学与分子工程学院的王剑波教授(点击查看介绍)课题组首次分别利用手性二价铑和一价铜催化的高对映选择性的硫叶立德[2,3]-sigma重排反应(Doyle-Kirmse反应),实现了不对称三氟甲硫基化过程,同时完成了手性叔碳的构建。该反应具有优秀的产率和对映选择性(高达98%的产率和99%的ee值)。相关成果发表在Nature Chemistry 上,第一作者是王剑波教授课题组的博士研究生张志坤(点击查看介绍)。

图1. 过渡金属催化的不对称三氟甲硫基化反应。图片来源:Nature Chem.
如图1a所示,目前仅有少量关于不对称三氟甲硫化反应的报道,如2013年Magnus Rueping等人报道的利用N-三氟甲硫基的邻苯二甲酰亚胺为亲电的“SCF3”源,在奎尼丁催化下对β-酮酯的三氟甲硫化。此外,金鸡纳碱Cinchona alkaloid、基于茚满结构的手性硫催化剂等催化的三氟甲硫化反应也相继报道,但这些报道的底物基本都限于β-酮酯类,因此,开发新的不对称三氟甲硫基化反应仍然非常重要。
王剑波教授课题组一直致力于基于卡宾过程的有机合成方法学的研究,并在相关领域取得了重要的研究成果。在金属卡宾的反应中,该课题组一直致力于研究Doyle-Kirmse反应(Coord. Chem. Rev., 2010, 254, 941-953)。在催化的对映选择性Doyle-Kirmse反应中,于2002年实现了当时最高的78%的对映选择性(J. Org. Chem., 2002, 67, 5621-5625)。随后他们又利用手性辅基和大位阻配体的策略实现了高对映选择性的Doyle-Kirmse反应,其中配体只起到了位阻作用而没有起到手性诱导作用(J. Am. Chem. Soc., 2005, 127, 15016-15017)。此后,该类反应的不对称催化鲜有报道,而催化的高对映选择性Doyle-Kirmse反应至今尚未实现。
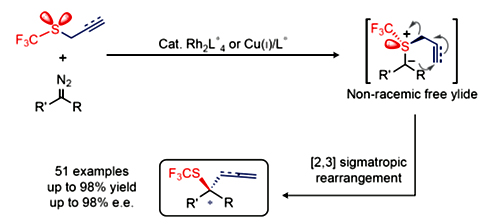
图2. 利用催化的高对应选择性Doyle-Kirmse反应来实现不对称三氟甲硫基化。图片来源:Nature Chem.
首先,作者以三氟甲硫基化合物1和重氮化合物2为模板反应,对反应条件进行了筛选和优化。如图3所示,作者发现手性脯氨酸配位的二价铑催化剂表现出良好的对映选择性,重氮化合物中酯基部分的位阻对反应的对映选择性也具有重要影响,当酯基部分是乙酯的时候能够得到最好的结果,而当乙酯变为异丙酯或者叔丁酯时,产率和对映选择性会明显降低(entry 13, 14, 15)。作者还发现溶剂和温度对反应的对映选择性也具有非常重要的影响,最终得到最佳反应条件:使用正戊烷作溶剂,反应温度为-30 ℃,重氮化合物2中的R定为乙基,1 mol% Rh2(S-DOSP)4为催化剂,得到95%的产率和91%的对映选择性(entry 21)。当选用Rh2(R-DOSP)4作为催化剂时,产率依然优秀,并且以优秀的对映选择性得到另外一个对映异构体(entry 22)。
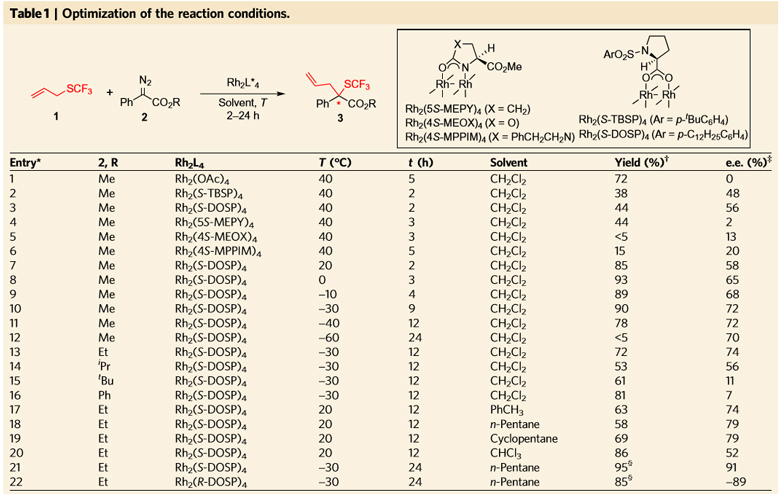
图3. 反应条件的筛选。图片来源:Nature Chem.
有了最佳反应条件,作者对底物进行了扩展。如图4所示,对于烯丙基底物1和重氮化合物2的反应,2中的R可以是苯基、萘、噻吩以及取代的苯或者萘,苯环的邻位、对位可以是烷基、烷氧基或者卤素,考察的十几种底物都取得了优秀的产率和对映选择性(3a-3m)。但当苯环的对位是甲氧基时,由于重氮酯化合物发生二聚,使产率降低(3e, 73%, 79% ee),苯环的间位为酯基取代时产率也较低(3k),原因可能是底物在正己烷中溶解性较差。当R为苯乙烯、萘乙烯、丙烯或者苯基丁二烯时,考察的十几种底物也都取得了优秀的产率和对映选择性(5a-5n)。当含有三氟甲硫基的底物为炔丙基底物6时,也能以中等到良好的收率及对映选择性得到相应的联烯产物,R为苯基、取代的苯基、苯乙烯基、噻吩或者丙烯等,表现出良好的官能团兼容性,但苯基邻位为卤素取代时产率降低(7e,7l)。
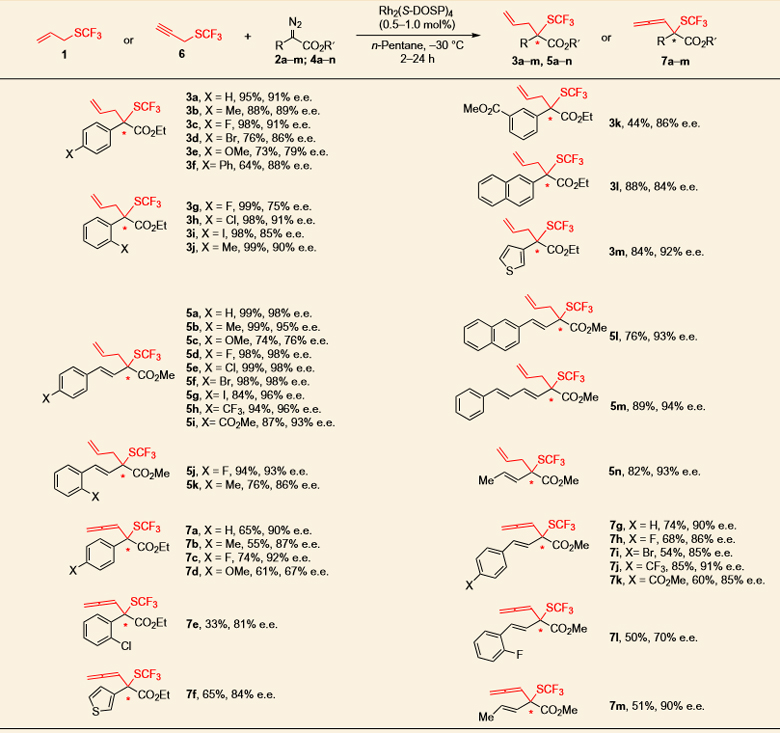
图4. 手性二价铑催化的不对称Doyle-Kirmse反应的底物普适性研究。图片来源:Nature Chem.
作者还通过将产物3f中的酯基使用氢化铝锂还原后和对硝基苯甲酰氯反应得到酯化合物8,并培养单晶确定了其绝对构型为R 型。
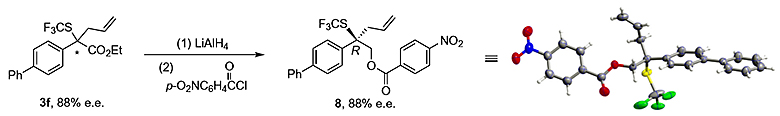
图5. 绝对构型的确定。图片来源:Nature Chem.
除了铑催化的Doyle-Kirmse反应以外,作者还尝试了一价铜催化的反应,经过大量的配体筛选得出最佳手性BOX配体,以Cu(CH3CN)4PF6(5 mol%)为催化剂,手性配体L*(6 mol%),在对二甲苯中30 ℃下反应可以取得最好的结果。在底物普适性的研究中,该反应也表现出良好的官能团兼容性,化合物10j也由X-射线单晶衍射确定了绝对构型。但苯环对位为甲氧基的底物(10g)以及Ar为噻吩的底物产率较低(10k)。苯乙烯基取代的重氮酯底物对映选择性较差,炔丙基三氟甲硫基底物的反应性也不够理想。
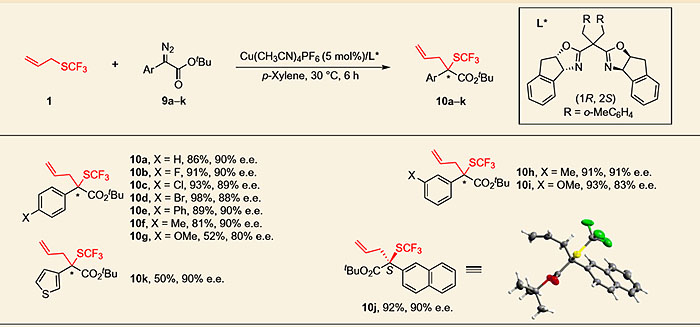
图6. 手性一价铜催化的不对称Doyle-Kirmse反应的底物普适性研究。图片来源:Nature Chem.
为了系统地研究反应机理,作者进行了一系列的控制实验。如图7a所示,三氟甲硫基化合物11和重氮酯2a在不同的非手性或者手性铑催化剂条件下得到重排产物12,dr选择性几乎一致,这说明反应有可能经历自由的硫叶立德过程。图7b的控制实验中,重氮底物和对称的含硫化合物13在手性的铑催化剂下反应,ee值几乎为零,这进一步说明了反应是经历自由的硫叶立德过程。图7c说明了自由的硫叶立德产生的过程。如图7d所示,该反应的不对称诱导过程可能涉及到手性金属卡宾的生成,随后诱导生成手性的自由硫叶立德,再通过协同的[2,3]-sigma重排得到最终产物。该反应能够产生较好的对映选择性主要是由三氟甲硫基特殊的立体电子效应决定的。
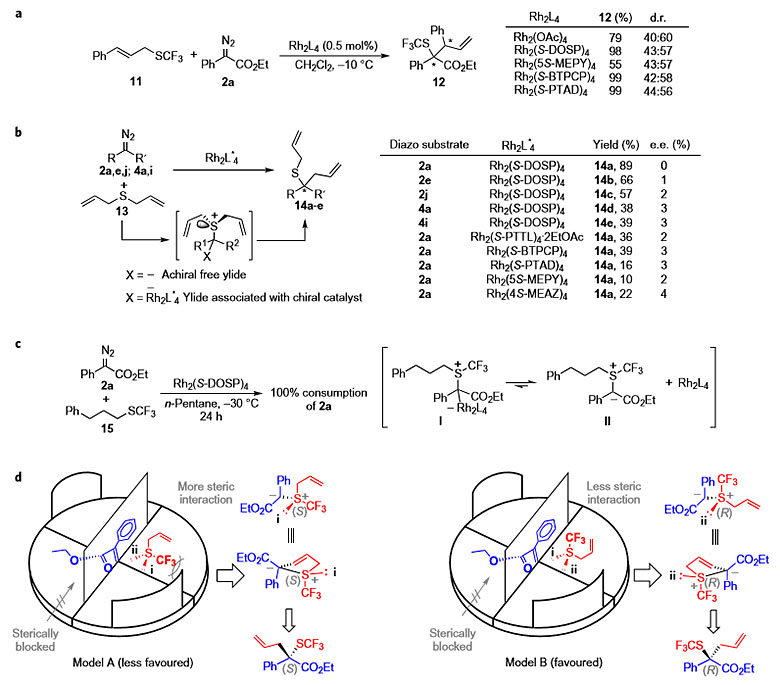
图7. 控制实验及可能的反应机理。图片来源:Nature Chem.
——总结——
王剑波教授课题组首次分别利用手性二价铑和一价铜催化的高对映选择性硫叶立德的[2,3]-sigma重排反应(Doyle-Kirmse反应),实现了不对称的三氟甲硫基化过程,同时完成了手性叔碳的构建,与此同时他们还研究了可能的反应机理。该反应条件温和、产率和对映选择性中等到优秀、官能团兼容性好,提供了全新的构建含三氟甲硫基叔碳中心的构建方法,对于三氟甲硫基的手性引入具有重要意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic asymmetric trifluoromethylthiolation via enantioselective [2,3]-sigmatropic rearrangement of sulfonium ylides
Nature Chem., 2017, DOI: 10.1038/nchem.2789
王剑波教授
http://www.x-mol.com/university/faculty/8605
课题组主页
http://www.chem.pku.edu.cn/physicalorganic/home.htm
张志坤博士
http://www.x-mol.com/university/faculty/41620
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号