吡喃酮类新型生物合成机制:周环反应分叉现象
隐裂壳菌(Delitschia sp.)常被发现于落叶或者腐木中。亚利桑那州立大学的Gunatilaka等人在佛罗里达州的棕榈树落叶中发现了一种新型隐裂壳菌(Delitschia sp. FL1581)。[1] 此菌能够产生一种名为隐裂壳菌吡喃酮A (delitschiapyrone A) (下文简称为“A”)的天然产物,对不同类型的人类肿瘤细胞具有细胞毒性。“A” 具有相当复杂的稠杂环/桥环骨架、代表性多取代吡喃酮官能团、以及五个连续立体中心。推测的生物合成途径中包含了一个关键的exo Diels-Alder 环加成反应,首先生成隐裂壳菌吡喃酮B (delitschiapyrone B) (下文简称为“B”),紧接着一个α-酮醇重排反应以及分子内半缩酮环化反应生成“A”。
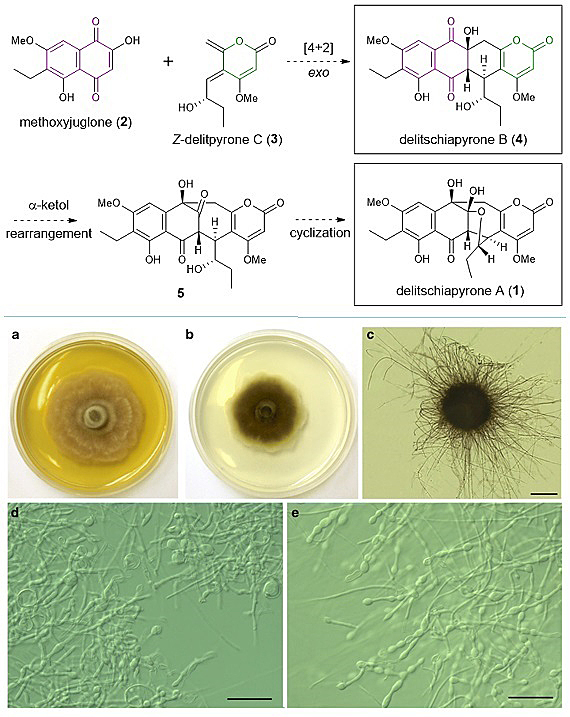
图1. 隐裂壳菌吡喃酮A的生物合成推测,以及隐裂壳菌图示。图片来源: JACS, Mycological Progress 2021, 20, 39-50.
此菌仅通过三步反应就高效地构建了“A”的复杂稠环结构,吸引若干合成化学工作者纷纷效仿。日本东北大学的Enomoto课题组据此生物合成途径策划并完成了“A”的仿生高效全合成,并发现此三步生物合成反应能够在一锅中完成。[2] 同时,在此合成实验中“B” 第一次被分离得到,从而验证了此生物合成途径的有效性。其中,作者又发现了一个有意思的现象:“A”和“B”的比例能够通过不同的反应溶剂来调控。
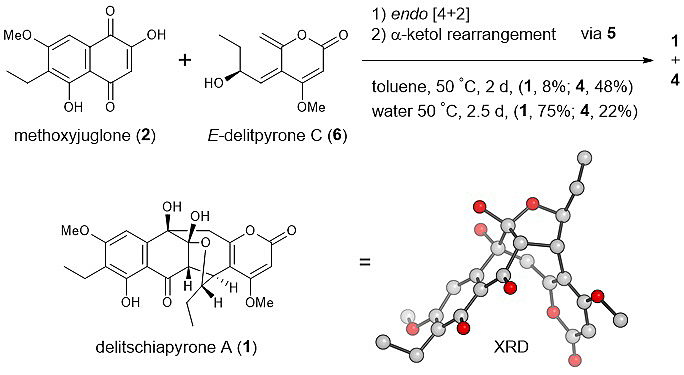
图2. 隐裂壳菌吡喃酮A的仿生全合成。图片来源:JACS
α-酮醇重排反应涉及σ键的重排,在非催化条件下很难发生。为什么真菌能在室温下完成此反应?为何在化学合成中未加入任何催化剂的情况下,稍微加热此反应便可发生?为什么此反应只生成了一个立体异构体?带着这一系列问题,加州大学洛杉矶分校的邹一可博士在Ken Houk教授的指导下对此天然产物生物合成以及化学合成机理开展了计算化学研究。生物合成前体delitpyrone A存在E、Z两种构型,均可与methoxyjuglone进行Diels-Alder反应生成“B”。E构型反应的能垒较低(21.9 kcal/mol),能够在室温下进行。“B”的四元稠环系统与四环素类抗生素类似,热力学稳定性较高(-32.9 kcal/mol),但这也导致了下一步α-酮醇重排反应极难发生。不出所料,计算结果表明由“B”通过α-酮醇重排反应生成“A”的能垒是42.2 kcal/mol,“A”的热力学稳定性比 “B”低5.9 kcal/mol。因此无论从动力学或者是热力学的角度出发,此α-酮醇重排反应均不能发生。但是在生物合成以及化学合成实验中均分离得到了“A”,在水作为溶剂的情况下“A”甚至是主产物。这表明“A”一定是通过一条不同寻常的反应路径生成。
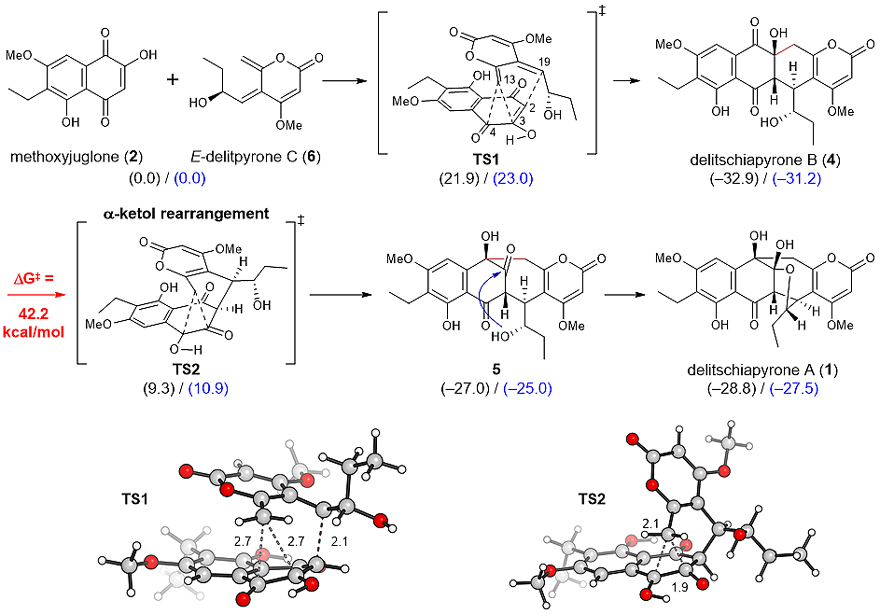
图3. 隐裂壳菌吡喃酮素化学合成以及生物合成途径的DFT计算化学研究。图片来源:JACS
自从2002年Caramella课题组首次报道环戊二烯的二聚反应涉及到周环反应“分叉”现象以来,[3] 越来越多的反应分叉现象被报道 [4-8] ,并有可能是有机化学中一个非常普遍的现象。简而言之,反应分叉现象就是通过同一过渡态得到多个产物,颠覆了之前同一过渡态有且仅有一个产物的共识。那么 “A”和“B”的生成是否共享了一个过渡态,而没有经历之前实验文章中提出的α-酮醇重排反应?针对这个核心疑问,作者对生成“B”的Diels-Alder反应进行了分子动力学研究,以探明此周环反应是否存在分叉现象。
在化学反应中,分子不但因为相互碰撞具有了动能,而且本身也在不断振动。在反应到达过渡态的那一时刻,分子中参与反应官能团可能正朝着不同的方向振动,这便是反应分叉现象的根源。例如在图4b的过渡态中,末端烯烃向右振动会形成键1,向左振动便形成键2,从而对应了“B”和“A”两种产物。产物的比例由势能面的对称性决定。作者分别模拟了甲苯中1000多个反应分子通过同一过渡态生成“B”或“A”的动态过程,97%的反应物生成了“B”,3%的反应物生成了“A”,这与实验得到的产物比例吻合,证明了“A”的生成确实不需要经过α-酮醇重排。
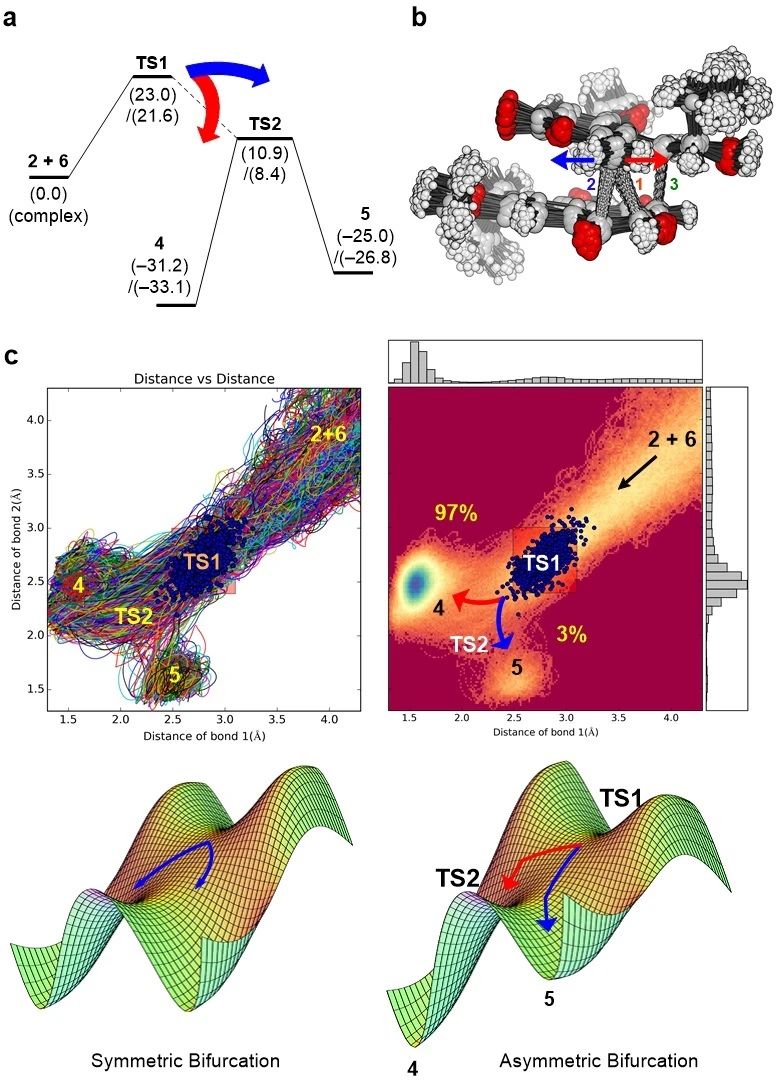
图4. 隐裂壳菌吡喃酮素生成过程中的反应“分叉”现象。图片来源:JACS
但在水溶液中,为什么“A”却成为了主产物?作者认为在水溶液中,反应物methoxyjuglone(2)的烯醇羟基会发生解离,以氧负离子的形式存在。反应物不同,分叉现象自然也会随之改变。如图5a所示,负离子过渡态TS1c的结构和中性过渡态TS1的结构有所不同,生成“A”的距离更短了(2.9 Å)。显性溶剂动力学模拟表明在水溶液中确实有更多的反应分子生成了“A” (80%),与实验比例(75%)吻合。
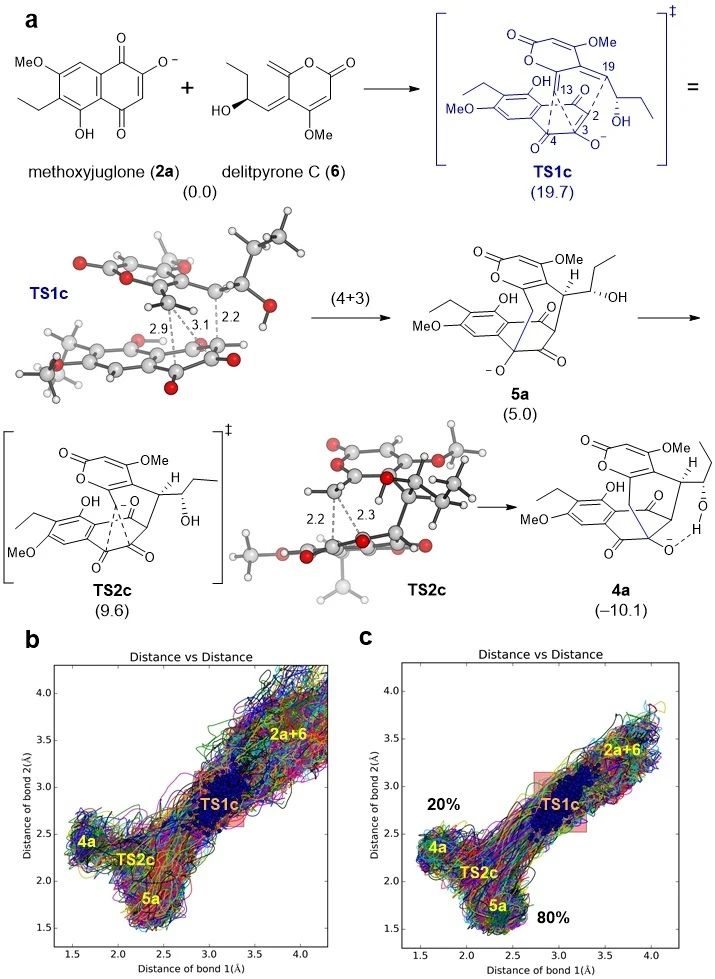
图5. 利用显性溶剂动力学模型模拟负离子反应中的 “分叉”现象。图片来源:JACS
通过DFT计算结合分子动力学模拟,作者阐明了隐裂壳菌吡喃酮A和B的生成机理。隐裂壳菌吡喃酮A不是通过实验论文中推测的α-酮醇重排反应历程生成的,而是通过分叉型环加成反应而生成。远早于化学家们发现反应分叉现象之前,微生物就已经学会了利用此现象来克服动力学以及热力学壁垒,高效地产生多个天然产物。
相关论文发表于J. Am. Chem. Soc.,邹一可博士与Ken Houk教授为此文共同通讯作者。这篇文章正文中多处插入了视频,以帮助读者理解。文中使用了北京科音自然科学研究中心 卢天 开发的gau_xtb程序。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Mechanisms and Dynamics of Synthetic and Biosynthetic Formation of Delitschiapyrones: Solvent Control of Ambimodal Periselectivity
Yike Zou*, K. N. Houk*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c05293
邹一可博士简介

加州大学洛杉矶分校Ken Houk组博士后研究员,主要研究方向为人造酶设计、天然酶改造、催化反应机理研究。博士阶段师从宾夕法尼亚大学Amos Smith教授,专攻复杂天然产物全合成。之前从事天然产物的提取分离鉴定。发表SCI论文40余篇。荣获2016国家优秀自费留学生奖学金。
参考文献:
[1] Luo, J.-G.; Wang, X.-B.; Xu, Y.-M.; U’Ren, J. M.; Arnold, A. E.; Kong, L.-Y.; Gunatilaka, A. A. L., Delitschiapyrone A, a Pyrone–Naphthalenone Adduct Bearing a New Pentacyclic Ring System from the Leaf-Associated Fungus Delitschia sp. FL1581. Org. Lett., 2014, 16, 5944-5947.
[2] Kurasawa, K.; Kwon, E.; Kuwahara, S.; Enomoto, M., Bioinspired Total Synthesis of Delitschiapyrone A. Org. Lett., 2018, 20, 4645-4648.
[3] Caramella, P.; Quadrelli, P.; Toma, L., An Unexpected Bispericyclic Transition Structure Leading to 4+2 and 2+4 Cycloadducts in the Endo Dimerization of Cyclopentadiene. J. Am. Chem. Soc., 2002, 124, 1130-1131.
[4] Zhang, H.; Novak, A. J. E.; Jamieson, C. S.; Xue, X.-S.; Chen, S.; Trauner, D.; Houk, K. N., Computational Exploration of the Mechanism of Critical Steps in the Biomimetic Synthesis of Preuisolactone A, and Discovery of New Ambimodal (5 + 2)/(4 + 2) Cycloadditions. J. Am. Chem. Soc., 2021, 143, 6601-6608.
[5] Liu, F.; Chen, Y.; Houk, K. N., Huisgen's 1,3-Dipolar Cycloadditions to Fulvenes Proceed via Ambimodal [6+4]/(4+2) Transition States. Angew. Chem. Int. Ed., 2020, 59, 12412-12416.
[6] Xue, X.-S.; Jamieson, C. S.; Garcia-Borràs, M.; Dong, X.; Yang, Z.; Houk, K. N., Ambimodal Trispericyclic Transition State and Dynamic Control of Periselectivity. J. Am. Chem. Soc., 2019, 141, 1217-1221.
[7] Yang, Z.; Yang, S.; Yu, P.; Li, Y.; Doubleday, C.; Park, J.; Patel, A.; Jeon, B.-s.; Russell, W. K.; Liu, H.-w.; Russell, D. H.; Houk, K. N., Influence of water and enzyme SpnF on the dynamics and energetics of the ambimodal [6+4]/(4+2) cycloaddition. Proc. Natl. Acad. Sci. USA, 2018, 115, E848.
[8] Yu, P.; Patel, A.; Houk, K. N., Transannular [6 + 4] and Ambimodal Cycloaddition in the Biosynthesis of Heronamide A. J. Am. Chem. Soc., 2015, 137, 13518-13523.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号