Science综述:芳烃远程C(sp²)-H键活化策略
C-H键可以说是芳香化合物中最常见的键,C-H键官能团化也备受有机化学家的关注。近年来,过渡金属催化的C-H键活化已成为一种强有力的合成工具,它不仅原子经济性和步骤经济性高,而且反应位点具有可控性,因此可以快速合成一些具有不同生物活性的区域异构体(图1A)。然而,与邻位C-H键活化相比,远程(间位或对位)C-H键活化更富有挑战性。尽管芳香亲电取代反应(SEAr)可在一定程度上通过电子效应控制区域选择性,但是也面临着选择性不理想的问题(图1B)。近日,印度孟买理工学院的Debarata Maiti等人在Science 上详细地总结了过渡金属催化的芳烃远程(间位或对位)C(sp2)-H键活化的反应策略,主要分为以下六种:(i)σ键活化辅助(图1C);(ii)共价键模板导向(图1D);(iii)非共价键相互作用导向(图1F);(iv)双功能模板导向(图1E);(v)瞬态导向基和无痕导向基辅助(图1G);(vi)无导向基参与(即配体调控或试剂调控,图1H)。
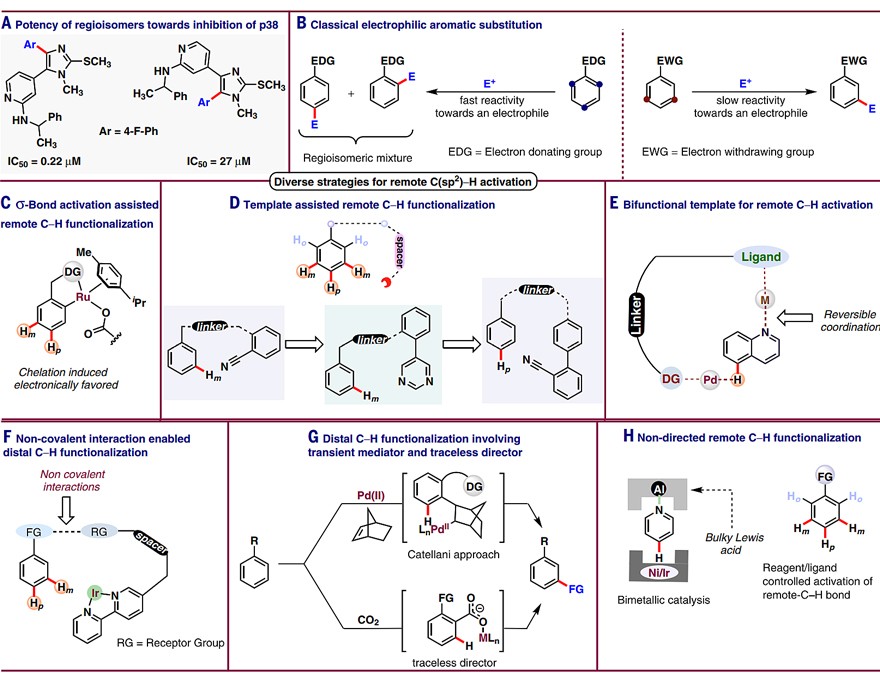
图1. 实现远程C-H键官能团化的策略。图片来源:Science
1、σ键活化辅助
1994年,Roper团队观察到金属钌络合物1可以实现苯环对位的硝化反应(图2A)。之后,Coudret教授在钌络合物3的卤化反应中观察到间位卤代的现象,并认为该反应是通过SEAr反应进行的。由于其位点选择性受钌-芳基物种的控制,因此被称为σ键活化辅助的C-H键官能团化。直到2011年,Ackermann团队首次在钌催化的芳烃邻位烷基化反应中检测到7%的间位烷基化产物7'(图2B,i)。与此同时,Frost团队报道了2-苯基吡啶的间位磺酰化反应(图2B,ii)。之后,Ackermann团队实现了邻位带有导向基的芳烃间位C-H键官能团化(图2B,iii)。2015年,Ackermann和Frost团队同时报道了芳烃和叔烷基卤代物的间位选择性C-H键官能团化反应,并揭示了反应机理(图2c)。在此基础上,化学家可以在带有导向基的芳烃间位引入卤原子(图2D i)、三级烷基片段(图2D ii)、含氟基团(图2D iii)、α-酯基(图2D iv)、苄基(图2D v、vi)、酯基(2D vii)以及硝基(viii)等。此外,梁永民团队采用双配体催化体系实现了三组分偶联反应(图2E)。相比之下,有关芳烃的对位官能团化报道则较少。2017年,Frost团队报道了2-嘧啶基苯胺衍生物28的对位烷基化(图2F)。2018年,赵应声团队实现了N-特戊酰基苯胺的对位二氟甲基化(图2G)。
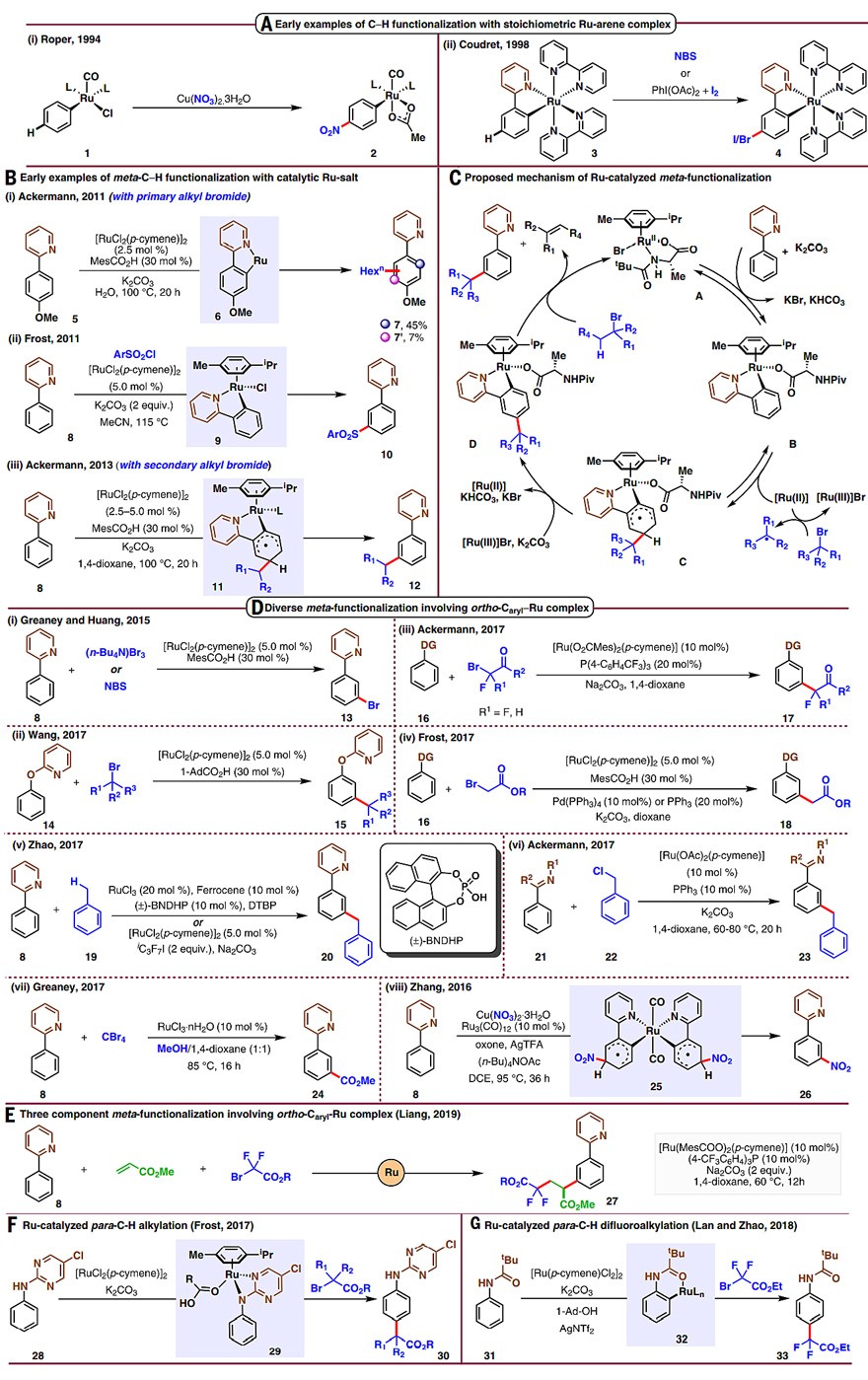
图2. 通过Ru-邻位C-H键活化辅助实现苯环间位和对位的C-H键官能团化。图片来源:Science
2、共价键模板导向
为了实现远程C-H键活化,可以将活性金属中间体直接接近远程C-H键,但是这需要先生成一个热力学上不利的大环预过渡态,所以远程导向模板必须满足如下要求:(i)模板既容易引入又容易脱除;(ii)导向模板和反应体系兼容;(iii)导向基团具有一定的配位能力;(iv)大环预过渡态具有一定的稳定性。2012年,余金权团队首次报道了线性氰基导向的末端模板(T1,图3A,i),并且高区域选择性地实现了苯甲醇及其衍生物的间位C-H键烯基化。在此基础上,化学家陆续开发了一系列模板(T2、T3、T4、T5、T6)且都以氰基为末端官能团,从而高区域选择性地实现了芳烃的间位烯基化、羟基化、乙酰基化、硅基化等(图3A i-v)。除此之外,羧酸、氮杂芳环、嘧啶也可作为末端官能团(图3A vi-x),提供类似的导向作用。需要指出的是,氰基作为末端官能团的模板也适用于铑催化的,芳烃间位C-H键烯基化反应(图3Bi、ii)。
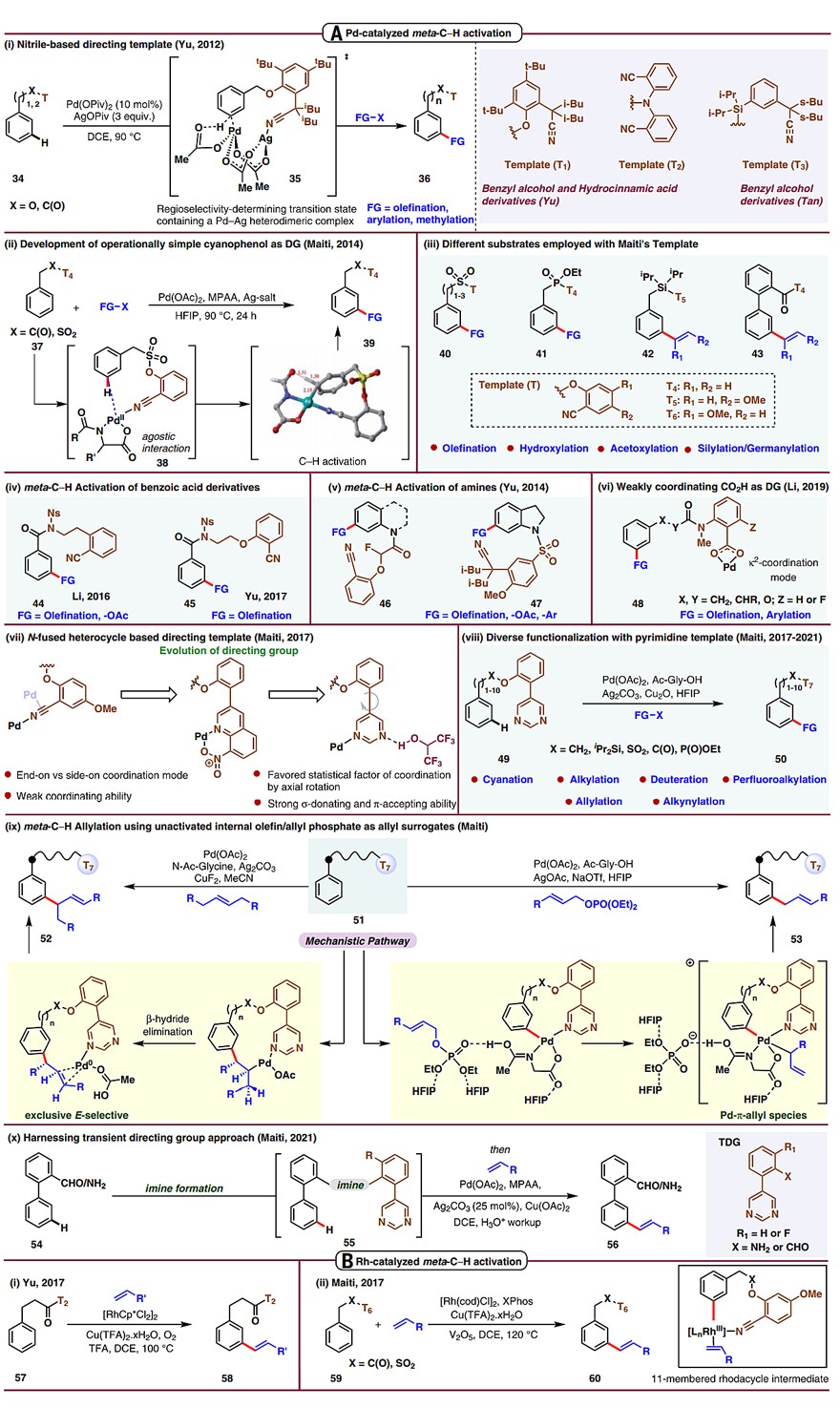
图3. 通过共价键模板实现间位C-H键官能团化。图片来源:Science
为了实现芳烃的对位官能团化,Maiti团队对模板进行了改造(即D形模板,图4A)。该模板仍然以氰基为末端官能团,但是采取对位硅醚取代的联苯为骨架,从而实现了甲苯和苯酚的对位烯基化反应(图4B)。随后,Maiti团队发展了第二代导向模板(即在含氰基的苯环上引入两个甲氧基),这不仅增强了反应活性,而且提高了导向能力(图4C),从而有效地实现了钯催化芳烃的对位硅基化和酮基化(图4D)以及铑催化芳烃的对位烯基化(图4E)。2019年,余金权团队采用酰胺连接的联芳基氰基模板实现了钯催化芳烃的对位乙酰氧化(图4F)。
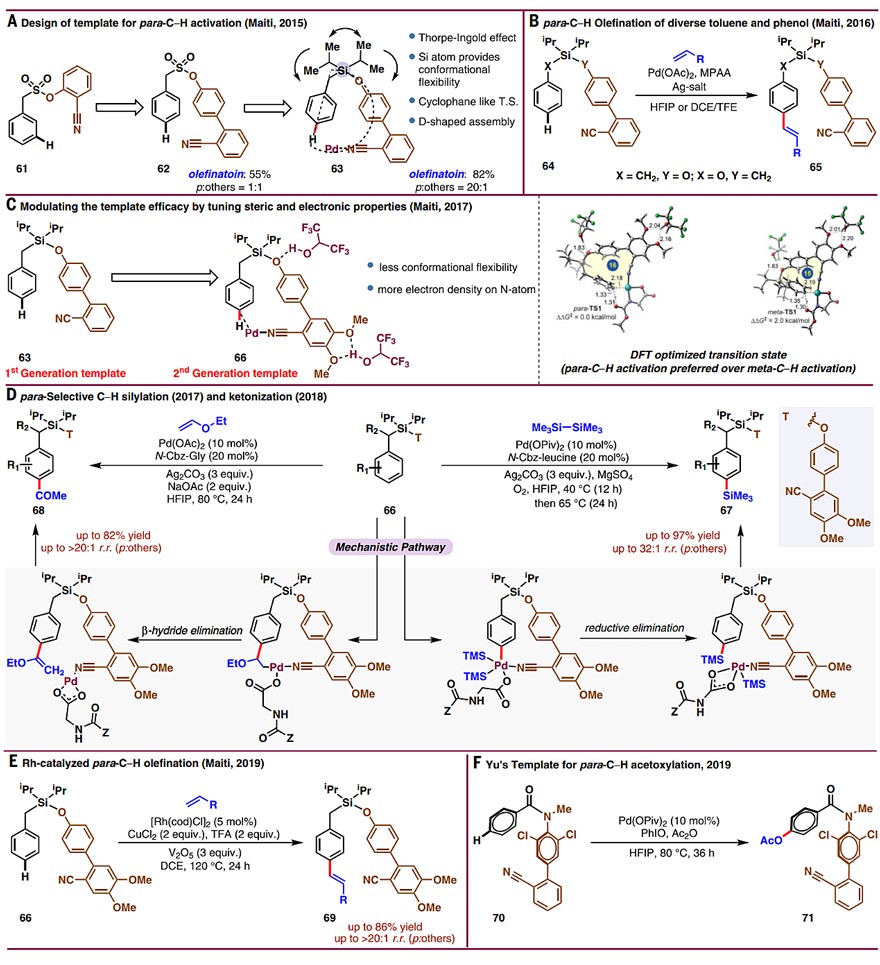
图4. 通过共价键模板实现对位C-H键官能团化。图片来源:Science
3、非共价键相互作用导向
近年来,将非共价键相互作用和过渡金属催化相结合以促进高位点选择性的C-H键官能团化反应迎来了一波研究热潮,目前已成功实现了铱催化芳烃间位和对位C-H键的选择性硼化反应(图5A)。其中针对芳烃间位的C-H键硼化反应共有五种弱相互作用模式,即氢键作用(图5B、5E)、次级B-N键相互作用(图5C)、离子对作用(图5D、5F)、氢键和离子对共作用(图5G)以及Lewis酸碱相互作用(图5H)。针对Ir催化的芳烃对位C-H键硼化反应,Chattopadhyay团队发展了一种L形配体,以优异的区域选择性实现了一系列酯基取代的芳基/杂芳基硼酸酯的合成(图5I)。值得一提的是,在苯甲酰胺的硼化反应中同样使用该L形配体,却得到了间位C-H键官能团化产物(图5J)。作者认为反应的区域选择性主要是由钾离子和酰胺上π电子云之间的阳离子-π相互作用决定的。
4、双功能模板导向
2017年,余金权团队开发了一种双功能模板介导的催化体系来活化杂芳烃的远程C-H键(图5K)。具体而言,反应采用双金属共催化模式,其中一个金属中心(钯或铜)与底物中的杂原子配位来控制底物取向,另一个金属中心(钯)则参与芳烃C-H键的活化,从而实现了3-苯基吡啶、喹啉和其它杂芳环的间位烯基化反应。
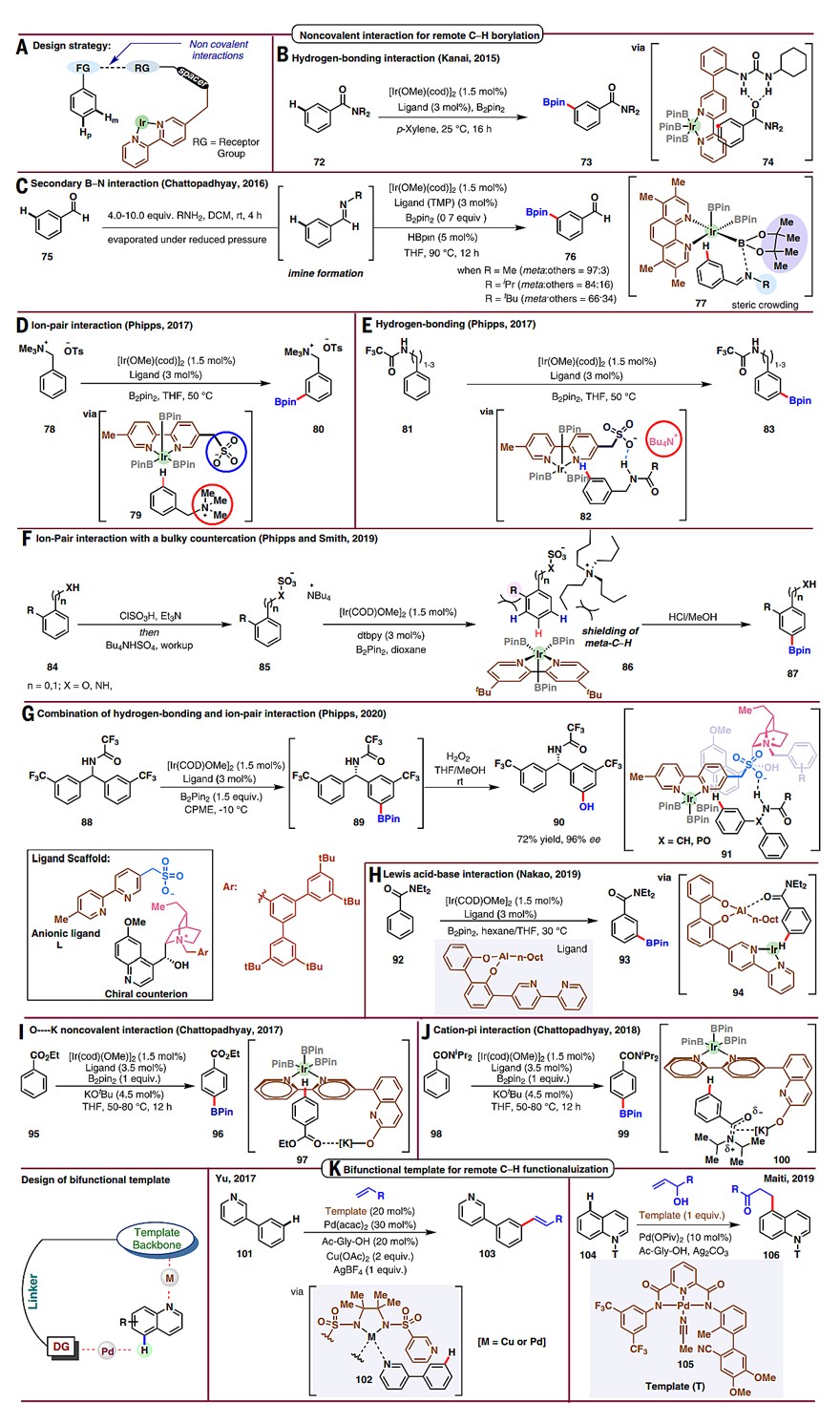
图5. 通过非共价键作用实现远程C-H键官能团化。图片来源:Science
5、瞬态导向基和无痕导向基辅助
瞬态导向基策略也可以有效地实现远程C-H键的官能团化。著名的Catellani反应便是以降冰片烯(NBE)为瞬态媒介的钯催化接力反应。2015年,余金权团队将这一设计巧妙地应用于苯基乙酰胺的间位C-H键烷基化反应中(图6A, i)。同年,董广彬团队也采用钯/NBE共催化体系实现了芳烃的间位C-H键芳基化(图6A,iii)。随后,不同种类的底物(如苯胺、苯酚、苄醇、苯乙酸等)都可以在钯/NBE的共催化体系下实现间位官能团化(图6A,iv)。2018年,余金权团队利用Pd-(+)-NBE-CO2Me催化体系实现了二芳基甲胺和高苄胺的立体选择性间位C-H键官能团化(图6A,v)。之后,该团队利用该策略进一步实现了氢化肉桂酸衍生物的对位C-H键芳基化。2020年,Maiti团队通过向底物中引入间位导向基实现了磺酰酯、磷酸酯和苯酚类化合物的对位C-H键芳基化(图6A,vi)。
相比之下,无痕导向基策略的关键在于导向基在单步反应中需要保持微妙的平衡,既要有一定的稳定性确保活化邻近的C-H键,又能轻易地原位脱除。从导向能力、可操作性、相对稳定性和容易脱除等角度考虑,羧酸基团有望成为无痕导向基。2011年,Larrosa团队采用羧酸为无痕导向基,实现了钯催化芳烃的间位C-H键芳基化(图6B)。
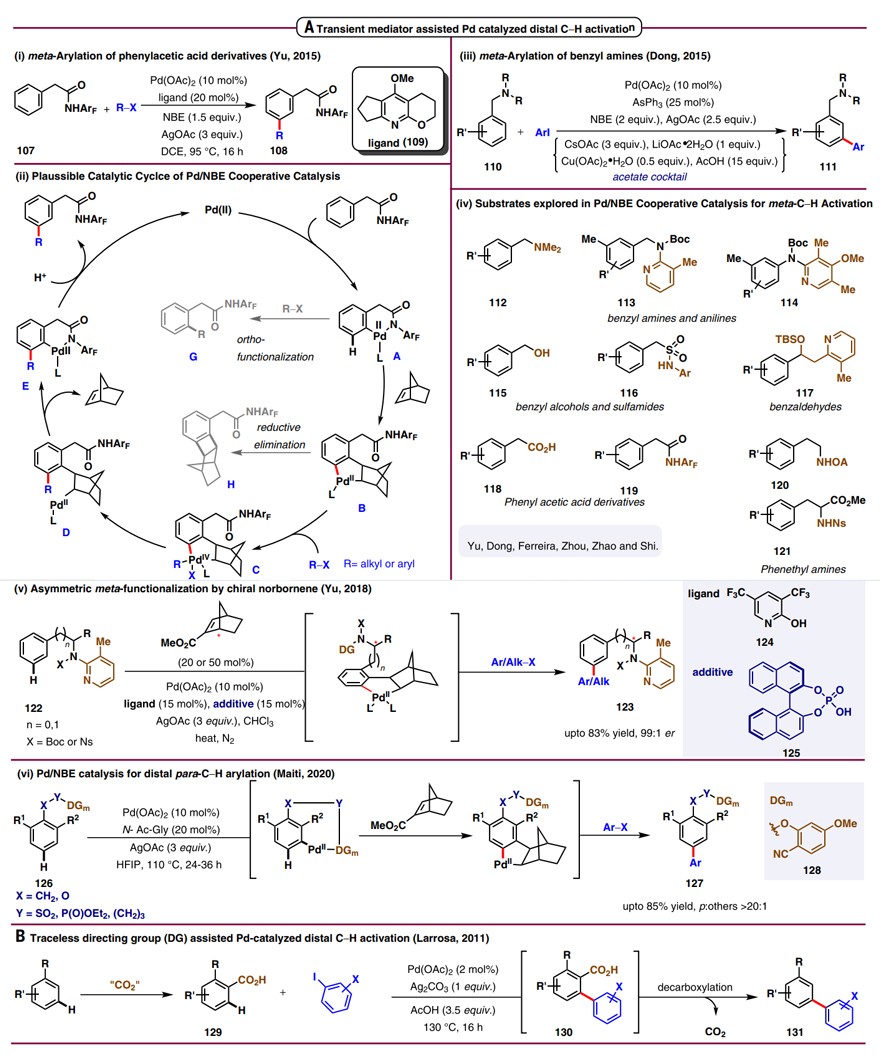
图6. 通过瞬态导向基和无痕导向基实现远程C-H键官能团化。图片来源:Science
6、无导向基参与(即配体调控或试剂调控)
前文介绍了导向基以及弱相互作用辅助的远程C-H键活化,除此之外,底物中取代基控制的远程C-H键活化也有报道。例如,1,2或1,3-双取代苯受取代基电子效应和位阻效应的影响,可以实现间位的C-H键硼化反应(图7A)。另外,催化剂、配体和试剂的设计也对C-H键活化的区域选择性起着至关重要的作用。2016年,Nakao团队采用镍/铝共催化策略,实现了芳基酰胺和芳基酮的对位烷基化(图7B)。2015年,Itami团队通过大位阻配体(Xyl-MeO-BIPHEP)调控,实现了单取代芳烃的对位硼化反应(图7C)。2017年,余金权团队报道了配体(3,5-二(三氟甲基)-吡啶-2-醇)控制的芳烃区域选择性烯基化反应(图7D,i);而van Gemmeren团队则是采用N-乙酰基-甘氨酸和吡啶衍生物为混合配体,实现了类似的转化。之后,Ritter、van Gemmeren和余金权团队分别实现了配体加速的芳烃选择性C-H键氰基化反应(图7D ii)。尽管他们采用的配体稍有不同,但是都表现出中等的区域选择性。2019年,Fernandez-Ibanez课题组采用Pd/S,O催化体系,实现了苯胺衍生物的对位烯基化反应(图7D,iii)。动力学实验表明2-异丙基-2-苯硫基乙酸配体有利于提高反应速率,这进一步支持了配体加速的C-H键活化机制。
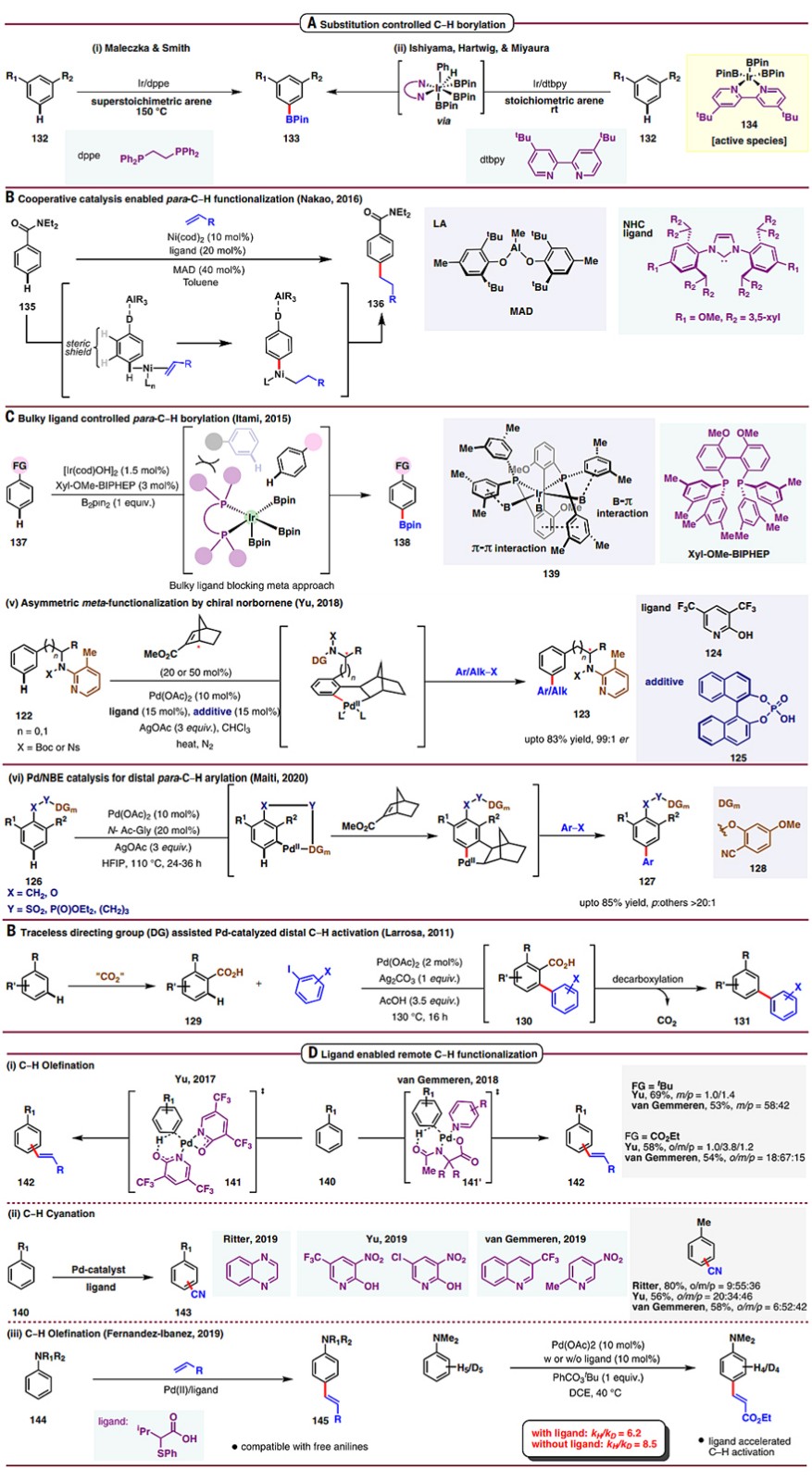
图7. 通过配体调控实现远程C-H键官能团化。图片来源:Science
此外,催化剂的发展对原子经济性和步骤经济性同样重要。2013年,Ritter团队采用N-氟代双苯磺酰胺试剂成功地实现了芳烃的对位磺酰胺化(图8A,i)。随后,他们又使用钯催化剂148和Ru(bpy)3(PF6)2,实现了芳烃的对位C-H键胺化反应(图8A ii)。2015年,Nicewicz团队报道了光诱导的芳烃选择性C-H键胺化反应(图8B)。2019年,Ritter团队发展了一例试剂控制的芳烃高位点选择性噻蒽化反应(图8C)。之后,Altman团队的研究工作进一步说明了试剂对底物的反应性和反应机制具有重要作用(图8D)。
2012年,Russell团队报道了金催化芳基硅烷和芳烃的氧化偶联反应(图8E,i),并且反应的位点选择性与SEAr反应一致。之后,Larrosa团队利用该催化循环实现了富电子芳烃和缺电子芳烃的选择性偶联(图8E,ii)。2009年,Gaunt团队报道了铜催化特戊酰胺的间位C-H键芳基化反应(图8E,iii)。随后该课题组发现不加铜催化剂也可以实现类似的间位C-H键芳基化,尽管收率较低。2011年,他们采用铜催化体系,实现了富电子苯酚/苯胺衍生物的对位芳基化反应(图8E,iv)。另外,两个芳烃的对位选择性交叉脱氢偶联反应也有相关报道(图8E,v),其特征是邻位带有导向基的芳烃选择性地偶联到富电子芳烃的对位。
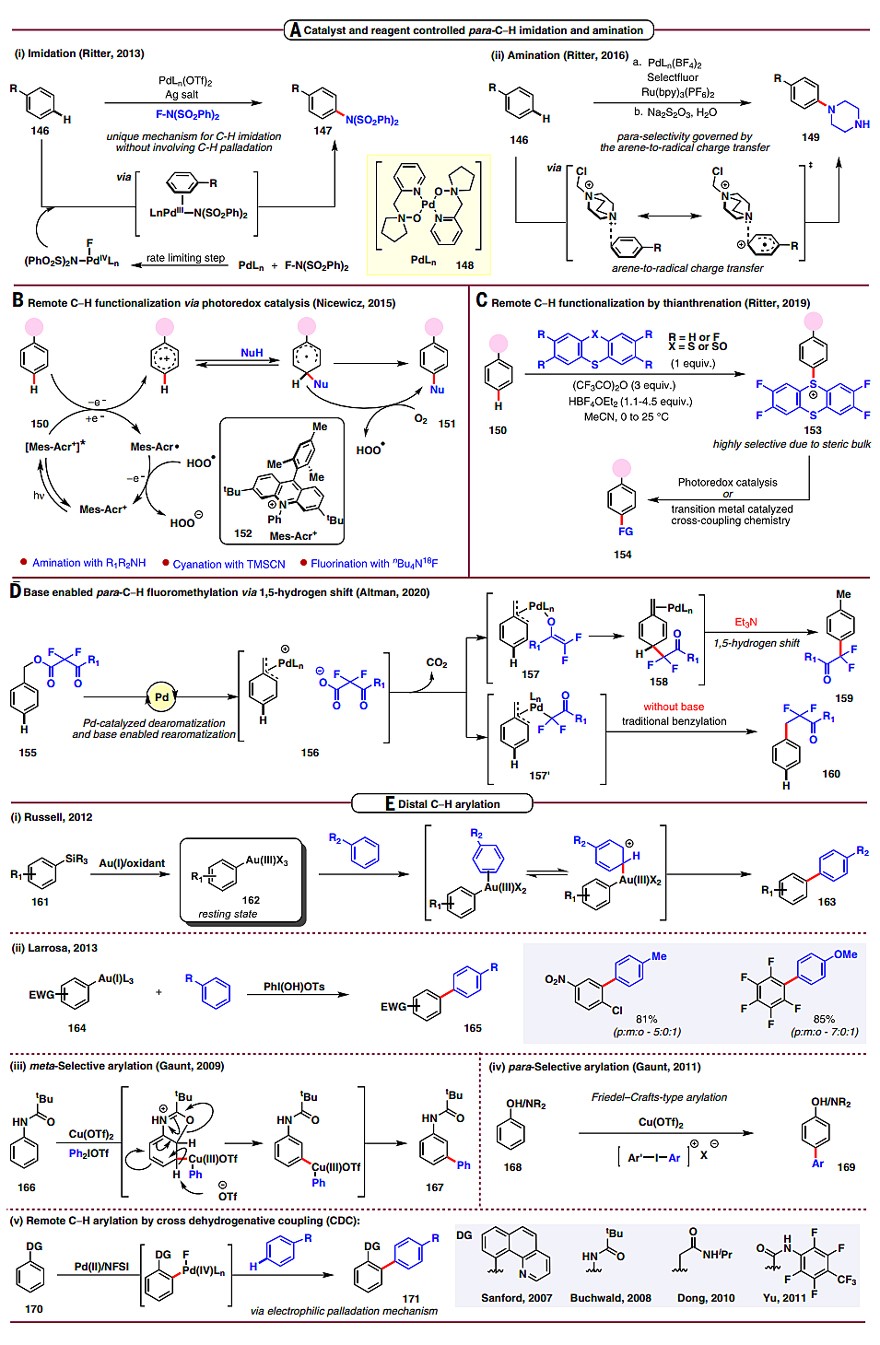
图8. 通过反应试剂控制远程C-H键官能团化。图片来源:Science
总结
Maiti教授详细地总结了过渡金属催化的芳烃远程(间位或对位)C-H键活化策略。然而,远程C-H键活化仍然存在一定挑战,例如需要发展更加绿色经济、可放大生产以及具有高转化数的催化体系。此外,该方法在药物分子中的合成应用仍旧有限,因此还需要更多的摸索和发现。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Arene diversification through distal C(sp2)−H functionalization
Uttam Dutta, Sudip Maiti, Trisha Bhattacharya, Debabrata Maiti
Science, 2021, DOI: 10.1126/science.abd5992
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号