Nature:氮杂芳环的选择性C-H键硼化
在现代有机合成化学中,芳基硼化物是一类非常重要的合成砌块,既可以作为Suzuki-Miyaura反应的偶联片段,又可以作为氧化、Chan-Lam偶联、氟化和同系化等反应的起始原料。早前合成这类化合物的方法一般有两种:一是格氏试剂和亲电性硼试剂之间的取代反应;二是钯催化亲核性硼试剂参与的Miyaura硼化反应。近年来,过渡金属催化的芳烃C-H键硼化反应得到了巨大发展,以Ir催化的吡啶C-H键活化为例,它可以实现吡啶远程C3位的硼化反应,从而促进了一系列C3位官能团化吡啶类化合物的合成(图1a上)。相比之下,C2位官能团化吡啶类化合物的合成路线较为繁琐,通常涉及多步反应。
在此背景下,英国曼彻斯特大学的Daniele Leonori教授课题组有了新的设想——能否将硼试剂经Minisci反应引入到氮杂芳环中。这意味着要寻找一个合适的硼自由基前体,它必须要满足以下三个条件:(I)硼试剂稳定、廉价易得,在温和的条件下就可以生成硼自由基;(II)硼自由基具有一定的亲核性;(III)硼化氮杂芳环产物既具有一定的化学稳定性,又具有足够的活性参与后续的官能团化。为此,他们选择三级胺-硼烷试剂(Me3N-BH3),创造性地通过自由基路径实现了C2位硼化氮杂芳环化合物的高效合成(图1a下)。具体而言,光催化剂(PC)在可见光的辐射下跃迁到激发态PC*,后者与过硫酸根离子A发生单电子转移(SET)生成硫酸根自由基负离子B,随后与胺-硼烷试剂(2)发生氢原子转移(HAT)形成胺-硼基自由基C。接着,硼自由基C与质子化的4-甲基-喹啉(1-H+)进行位点选择性加成(即Minisci加成),生成C2位官能团化的铵自由基阳离子中间体E;最后,中间体E经去质子化、与PC•+发生SET便可得到硼化的氮杂芳烃质子盐3-H+;或者直接与过硫酸根离子A发生SET生成3-H+(图1b)。相关结果发表在Nature上。
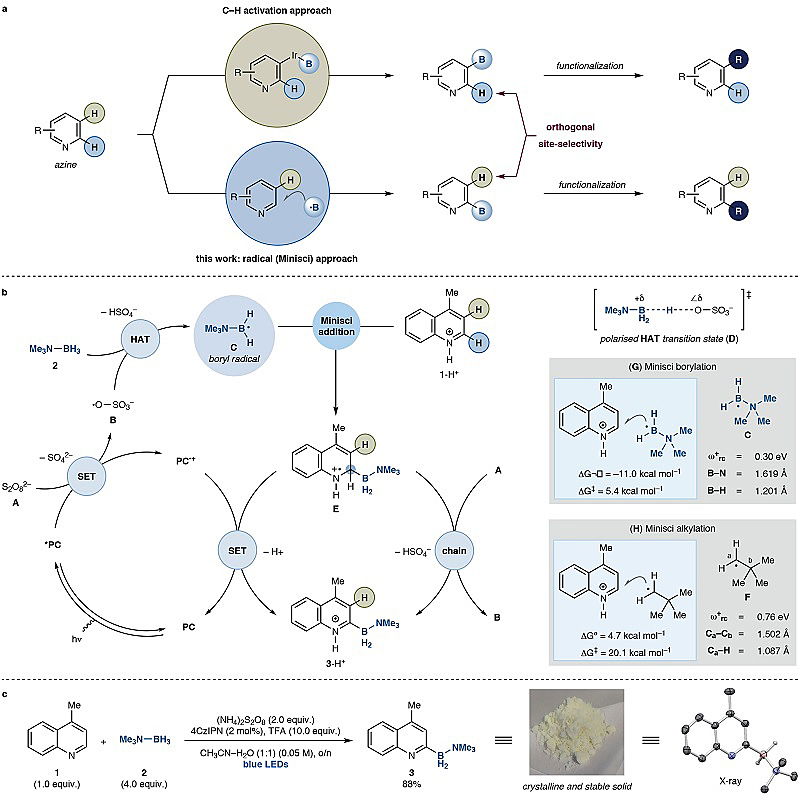
图1. 氮杂芳环类化合物的C-H键硼化策略。图片来源:Nature
首先,作者选择4-甲基-喹啉(1)为模板底物、Me3N-BH3(2)为硼自由基前体,对反应条件进行了探索(图1c)。经过一系列筛选,最终确认了最佳反应条件:即有机染料4CzIPN为光催化剂、过硫酸铵为氧化剂、三氟乙酸为Brønsted酸、乙腈-水为溶剂在室温和蓝光照射下进行反应,能以88%的收率得到目标产物3,后者是一种结晶型固体,在室温和空气中可稳定存在六个月以上,并且该反应还能以克级规模进行。值得一提的是,Brønsted酸在该反应中起到协同作用,具体而言:(I)促进过硫酸根离子A的单电子还原;(II)增强硫酸根自由基负离子B的亲电性,促使Me3N-BH3(2)的HAT过程更加高效地进行;(III)提高4-甲基-喹啉(1)的亲电性,使其与胺-硼基自由基C更易发生Minisci-硼化反应;(IV)阻止硫酸根自由基负离子B和产物3发生不期望的HAT。
在最优条件下,作者考察了底物的普适性(图2)。首先,他们考察了C4位取代的喹啉,发现该反应可以兼容氯原子(4)、羟基(5)。当底物中的C2位被烷基化时(即喹哪啶),硼化反应则以较低的收率(44%)发生在C4位(6)。值得一提的是,喹啉参与反应时得到了C2和C4位硼化的混合物(C2:C4=3:1)。此外,菲啶(8)能以较好的收率(86%)和单一的选择性在C6位进行硼化反应;而异喹啉(9、10)和酞嗪(11)的硼化反应则发生在C1位。喹唑啉醇也会在C2位发生硼化反应(12-14)。其次,作者考察了药物中常见的吡啶类化合物,能以中等至较好的收率得到C2位硼化产物(15-17),并且这些产物不会像硼酸那样容易脱硼,因此可以在数月内保持稳定。此外,2,6-二甲基吡啶在C4位发生硼化反应(18);而对于C5位氰基取代的底物(19),由于诱导效应和共振效应增强了C4位的反应活性,因此得到了C2和C4位硼化的混合物(C2:C4=2:1)。
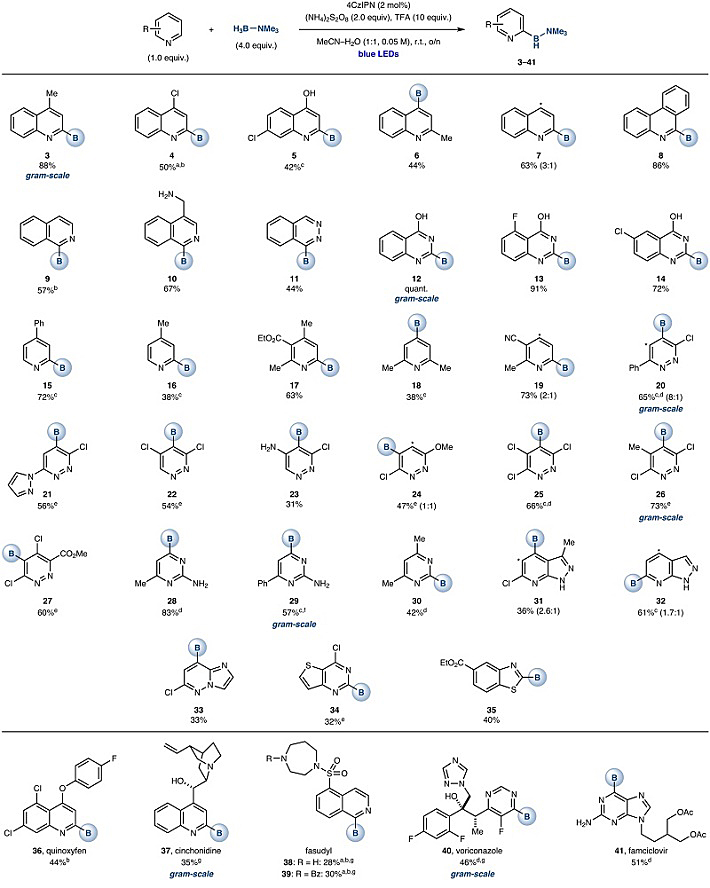
图2. 底物研究。图片来源:Nature
接着,作者考察了哒嗪类化合物,结果显示氯原子(20、22、25)、咪唑(21)、氨基(23)、甲氧基(24)、甲基(26)以及酯基(27)取代的底物都能以良好的收率完成转化。此外,该反应的位点选择性与C-H键活化形成互补。例如,C2位取代的嘧啶类化合物在C-H键活化的条件下,会在C5位发生反应;而在Minisci反应条件下,则在C4位进行反应(28、29)。当底物的C4位被烷基取代时,则在C2位进行反应(30)。对于药物分子而言(如肺动脉高压新药riociguar、白血病治疗药ponatinib、抗癌药物olmutinib等),其骨架上存在的氮杂吲哚(31、32)、咪唑并[1,2-b]哒嗪(33)和噻吩并[3,2-d]-嘧啶(34)都能顺利地发生Minisci反应,而且硼化反应的活性位点均在缺电子的骈六元环上。需要指出的是,苯并噻唑(35)是目前唯一适用的苯并五元环系底物。作者还考察了药物分子和农用化学品,均能以中等到良好的收率进行硼化反应(36-41),特别是伏立康唑(40)能以克级规模实现C6位硼化反应。
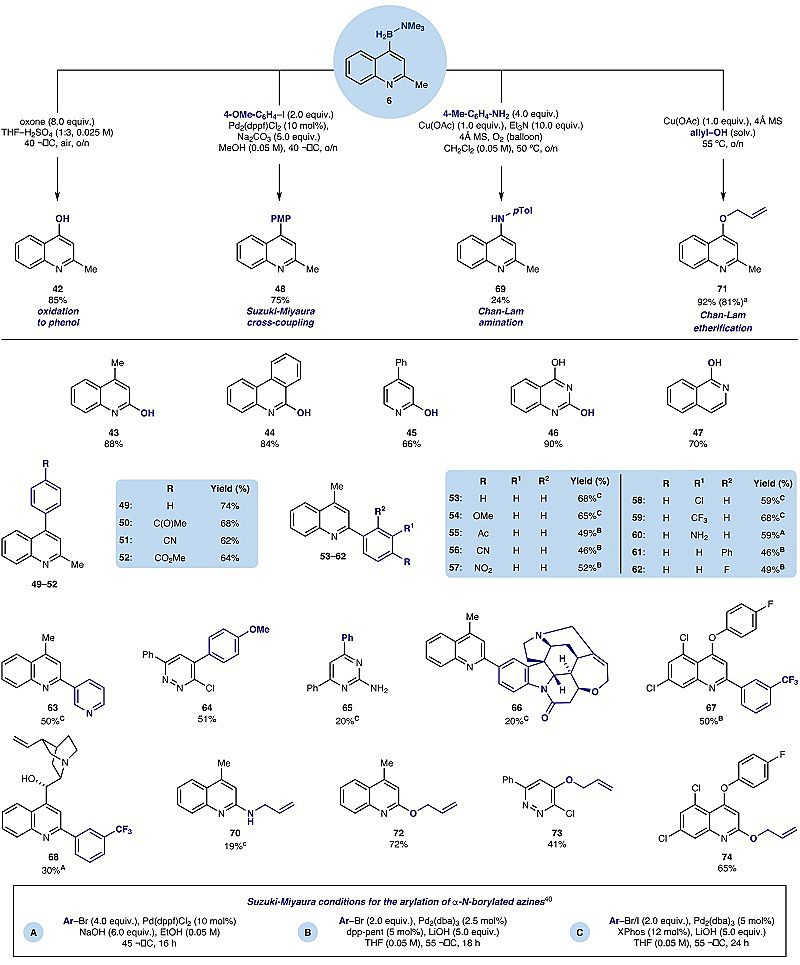
图3. 氮杂芳环胺-硼烷产物的转化研究。图片来源:Nature
最后,作者将这些硼化氮杂芳环产物用于主流有机硼化学反应和进一步转化,以体现该硼化策略的应用潜力。通常情况下,制备苯酚的常用方法是先硼化、后氧化,但是胺-硼烷产物由于Lewis酸性较弱,因此无法在H2O2/NaOH的条件下进行Brown氧化反应。有趣的是,作者发现产物6在酸性有氧的条件下可以和臭氧发生反应,并以高收率(85%)得到氧化产物42,而先前的方法则需要4步才能合成。此外,其它产物在类似的条件下也可以转化为相应的醇(43-47),而先前的方法则无法实现菲咯啉(44)和喹唑啉醇(46)的C2位氧化。尽管胺-硼烷衍生物参与Suzuki-Miyaura偶联反应时存在一些挑战(如N-B键较强不易水解成硼酸;还原芳基卤代物),但是作者发现化合物6和4-碘苯甲醚在Pd(dppf)2Cl2的催化下能顺利地进行偶联,以75%的收率得到所需产物(48),同时还可以耐受电中性(49)、缺电子的芳基碘化物(50、51)以及溴化物(52)。此外,喹啉类胺-硼烷产物3也可以和不同电性和位阻的芳基溴化物和碘化物(54-62)以及3-溴吡啶(63)发生反应;哒嗪类(20)和嘧啶类胺-硼烷产物(29)也能实现这一转化,以较低至中等的收率得到所需产物(64和65)。需要指出的是,结构复杂的3-溴士的宁也能兼容该反应,尽管收率较低(20%)。另外,胺-硼烷产物也能顺利参与Chan-Lam反应,进而生成sp2 C-N和C-O键。例如,化合物6在当量Cu(OAc)的催化下,可分别与对甲苯胺和烯丙基胺进行反应,从而得到C4-和C2-胺化产物(69、70)。同时,喹啉类胺-硼烷产物还可以与烯丙基醇发生Chan-Lam酯化反应,从而以中等至较好的收率生成所需产物(71-74)。
总结
Leonori教授研究团队另辟蹊径,发展了光催化的Minisci硼化反应,开拓了氮杂芳环类化合物和胺-硼烷之间的自由基加成反应。该反应与过渡金属催化的C-H键活化策略形成互补,可以实现具有不同位点选择性的高价值氮杂芳环类胺-硼烷的合成。与常见的硼试剂(如硼酸、硼酸酯、三氟硼酸盐等)相比,这类胺-硼烷化合物较为稳定、不易脱硼,而且具有足够的反应活性进行后续的氧化、Suzuki-Miyaura芳基化以及Cham-Lam胺化和酯化反应,具有广阔的应用前景。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A radical approach for the selective C–H borylation of azines
Ji Hye Kim, T. Constantin, M. Simonetti, J. Llaveria, N. S. Sheikh, D. Leonori
Nature, 2021, DOI: 10.1038/s41586-021-03637-6
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号