华东师大高栓虎团队JACS:三萜Perovskones、Hydrangenone和HydrangenoneB不对称全合成
活性天然产物研究一直是新药开发的重要来源。perovskones和 hydrangenones类天然产物主要从鼠尾草属药用植物中分离得到,属于多环型复杂三萜类天然产物。这类三萜具有广泛的生物活性,如抗肿瘤和抗疟活性,具有潜在成药价值。结构分析表明,该类分子具有共同的核心骨架(以perovskone为例):七环体系、八个连续的手性中心(包括两个全碳季碳和三个氧杂季碳中心)和高氧化态的稠环骨架C-D-E-F环,具有很高的合成挑战(图1)。
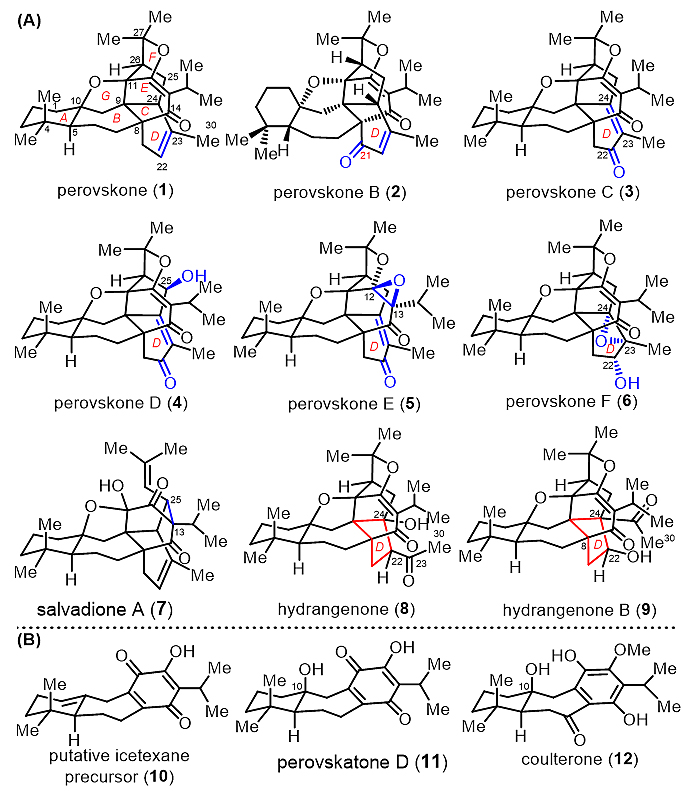
图1. 多环萜类天然产物结构:(A)Perovskone类三萜;(B)Icetexane型二萜
华东师范大学高栓虎(点击查看介绍)课题组,主要开展活性天然产物全合成及药物化学研究,围绕天然产物合成领域的关键科学问题,针对具有多环结构的复杂天然产物的全合成,探索和发展了高效的合成方法和策略。近年来,该课题组对光促进的烯醇化Diels-Alder反应(PEDA反应)进行了深入的研究,解决了其反应性、非对映选择性和对映选择性控制问题(Nat. Commun., 2017, 8, 622; Chem. Sci., 2021, DOI: 10.1039/D1SC00883H),成功构建了含一个或连续季碳中心的蒽醇/氢化蒽酚的核心骨架,完成了聚酮类天然产物oncocalyxone B(Nat. Commun., 2017, 8, 622)、多环萜类mycoleptodiscin A(Chin. J. Chem., 2019, 37, 135-139)、聚酮类天然抗生素(CCS Chem., 2020, 2, 800-812)和halenaquinone型醌类天然产物(Chem. Sci., 2021, 12, 4747-4752)的全合成。基于上述工作基础,近期,高栓虎课题组通过发散性的合成策略,运用不对称PEDA反应、生源启发的Diels-Alder反应,立体专一性的构筑了三萜的核心骨架,结合串联的Prins环化反应、环系断裂重组以及后期选择性的氧化,成功实现了复杂抗疟三萜perovskone的全合成,以及perovskones C, D, F, hydrangenone和 hydrangenone B的首次不对称全合成,相关工作发表在J. Am. Chem. Soc.上。

图2. 逆合成分析
作者从四取代烯烃15和全取代芳香醛化合物16出发,采用TADDOL类型配体,通过Ti(Oi-Pr)4促进不对称的PEDA反应(APEDA 反应),以高对映选择性和非对映选择性一步构建含三个连续季碳中心(其中一个为氧杂季碳)的三环骨架18(89% ee值, dr = 20:1),产率为94%,产物经简单重结晶ee值可达95%,其绝对构型通过单晶衍射确定(图3)。苄位羟基IBX氧化成双羰基化合物19,接着氢化脱除苄基再选择性还原成伯醇,经Appel反应碘代,通过三步转化高效得到自由基扩环前体20,在AIBN和Bu3SnH作用下发生自由基促进的扩环反应,成功构建天然产物所必需的6/7/6三环二萜骨架21,22。随后Li/NH3还原和DDQ重新芳构化两步去除苄位多余的氧化态,新制备的AgO(II)氧化即可以69%的总收率得到二萜天然产物perovskatone D和methyl-perovskatone D。
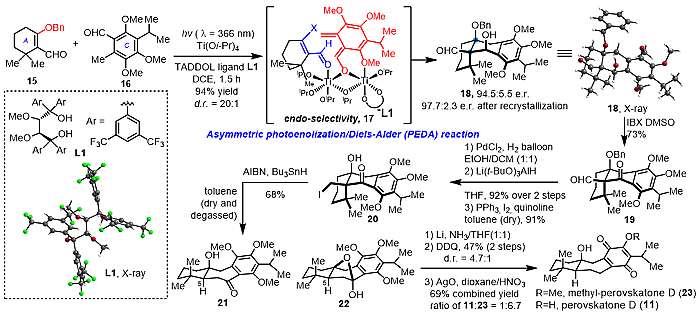
图3. 不对称PEDA反应和 Perovskatone D的全合成
接着作者采用生源启发的Diels-Alder反应,将上述制备的perovskatone D(11)和methyl-perovskatone D(23)分别和trans-α-ocimene发生反应,构建D环,经LiCl作用一锅法得到单一异构体产物26(图4)。随后,利用Lewis酸促进的串联环化反应,成功完成天然产物perovskone和天然产物类似物Δ23,24-perovskone的全合成。粗产物26在Cu(OTf)2条件下只能得到Δ23,24-perovskone(14),通过条件筛选发现在Bi(OTf)3作用下可以选择性地合成天然产物perovskone(1),与Δ23,24-perovskone(14)的比例为1.4:1。这一串联环化过程主要包括:半缩酮酸性条件下脱水成氧鎓中间体28、端位烯烃迁移、分子内的Prins环化和四氢呋喃环的形成,合成Δ23,24-perovskone(14)则需要再发生一次双键迁移,即三取代双键(C22=C23)经中间体29,迁移成四取代双键(C23=C24)。
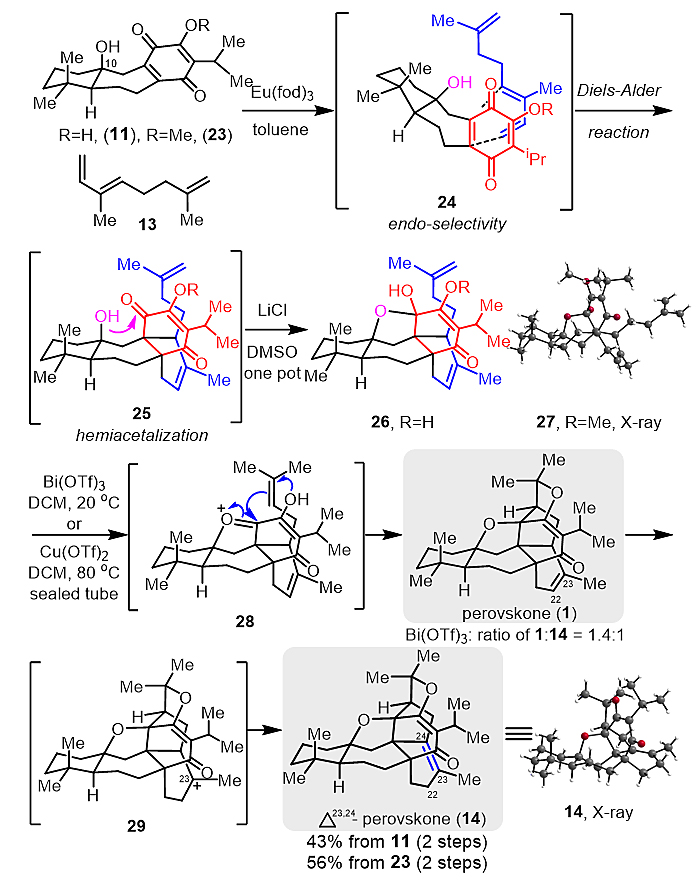
图4. 生源启发的perovskone和Δ23,24-perovskone的全合成
为了验证作者提出的环系切断再重组的仿生合成设想,作者首先臭氧化切断perovskone(1)中的C22=C23双键,得到的中间体30自发地发生分子内的aldol反应,以42%收率成功实现D环为五元环的hydrangenone B(9)的合成(图5A)。同样,对于hydrangenone(8)的合成,作者氧化切断的是Δ23,24-perovskone(14)中的C23=C24双键,得到的产物31比较稳定,需要经四氢吡咯和乙酸共同作用才能发生分子内aldol反应。由于perovskones C、D、F和Δ23,24-perovskone(14)骨架结构基本一致,只是氧化态略有区别。作者利用烯丙位选择性的氧化逐一实现这三个天然产物的合成(图5B)。具体过程是:在Na2CrO4氧化下选择性氧化C-22位得到perovskone C(3),同时伴有双键环氧化和C-25位氧化产物32和33。perovskone C(3)经Luche还原和m-CPBA氧化可以有效得到perovskone F(6)。Δ23,24-perovskone(14)中C23=C24双键两个烯丙位的一同氧化可以通过二氧化硒氧化实现,再利用DMP选择性氧化C-22位烯丙醇从而完成perovskone D(4)的合成。
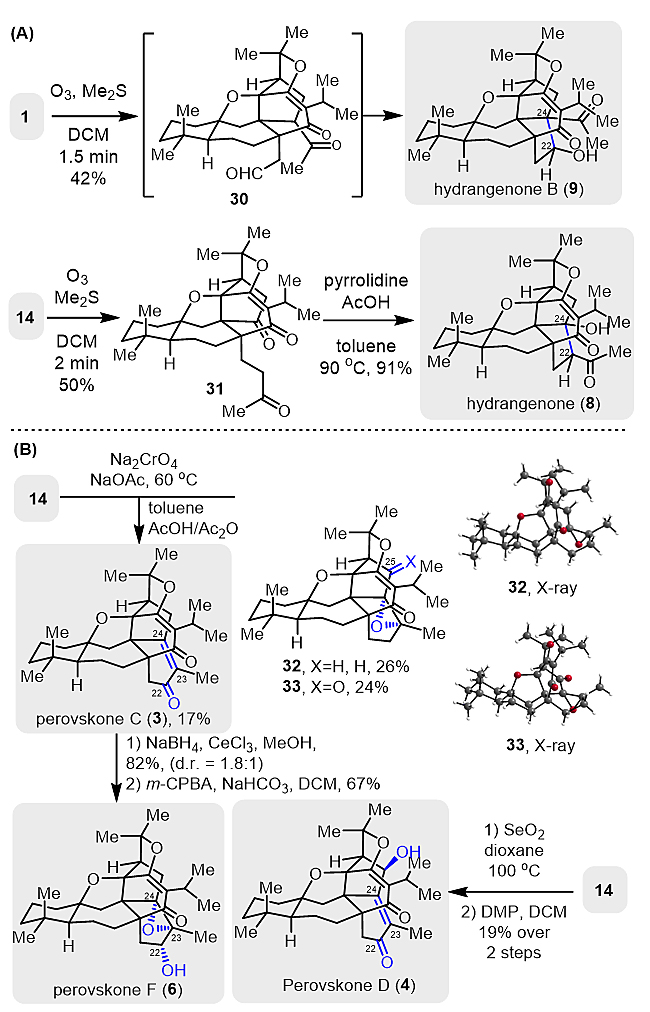
图5. Hydrangenone、Hydrangenone B和Perovskones C、D、F的不对称全合成
高栓虎课题组通过理性设计,发展了不对称PEDA反应,利用自由基促进的扩环反应、生源启发的Diels-Alder反应、串联的Prins环化反应以及环系切断重组、后期氧化等策略,从化合物15和16出发,以12到14步完成perovskone,perovskones C, D, F, hydrangenone和hydrangenone B 的不对称全合成。该工作表明:1)天然产物 perovskatone D可能是 perovskones类天然产物的生源合成前体;2)hydrangenone和hydrangenone B,结构中含有五元D环,其生源合成过程可能涉及环的氧化断裂和环的再生。这些研究结果有助于更好地理解和探索该家族天然产物的生源合成途径。
华东师范大学博士后杨鲍潮为论文第一作者,高栓虎教授为通讯作者。该研究工作得到国家自然科学基金(21971068, 21772044)、上海市学术带头人计划(18XD1401500)、上海市科委计划(18JC1411303)、曙光计划(19SG21)、中央高校基本科研基金、上海市“超级博士后”激励计划和中国博士后科学基金(2019M661419)等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric Total Synthesis and Biosynthetic Implications of Perovskones, Hydrangenone, and Hydrangenone B
Baochao Yang, Guoen Wen, Quan Zhang, Min Hou, Haibing He, and Shuanhu Gao
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c02674
导师介绍
高栓虎
https://www.x-mol.com/university/faculty/10566
https://faculty.ecnu.edu.cn/_s34/gsh/main.psp
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号