新颖甾体天然产物Phomarol的首例全合成
近日,南方科技大学李闯创教授(点击查看介绍)课题组,以温和的Brønsted酸促进的分子内[5+2]环加成反应等为关键策略,并首次发现分子内氢键调控该环加成反应的立体选择性,完成了具有挑战性的新颖甾体天然产物Phomarol的首例不对称全合成。
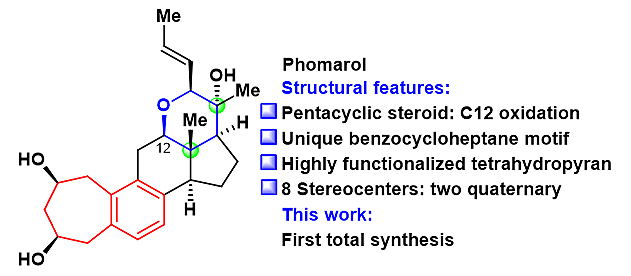
图1. 新颖甾体天然产物Phomarol
甾体天然产物在有机合成化学和药物研发中占有非常重要的地位,因此甾体化合物的化学合成一直受到国内外许多合成化学家的广泛关注。甾体phomarol于2016年从海洋水母 (Nemopilema nomurai) 的一种内生真菌的培养液中分离得到。然而,该天然产物没有单晶,A环上两个手性羟基与分子内的其它手性中心相距较远,加之C11和C19没有NOE信号,导致其结构难以得到精确的确定 (图2)。因此,有必要通过全合成来确定phomarol的结构。同时,通过全合成可以获得足量的天然产物进行深入的生物活性研究。
Phomarol含有紧凑的[7-6-6-5-6]五环骨架和8个手性中心 (2个季碳手性中心)。此外,phomarol含有一个C12氧化态和高度官能团化的四氢吡喃环。在现有的甾体天然产物的合成中,还没有高效的策略引入C12氧化态。尤其值得注意的是,phomarol含有一个独特的苯并七元环结构,这也是目前唯一一个具有该结构的甾体天然产物。因此,phomarol具有很大的合成挑战性。此外,苯并七元环结构也存在于药物和其它天然产物中 (如生物碱、萜类、多酚和聚酮,化合物2-5,图2)。因此,需要发展新的合成策略来构建苯并七元环。
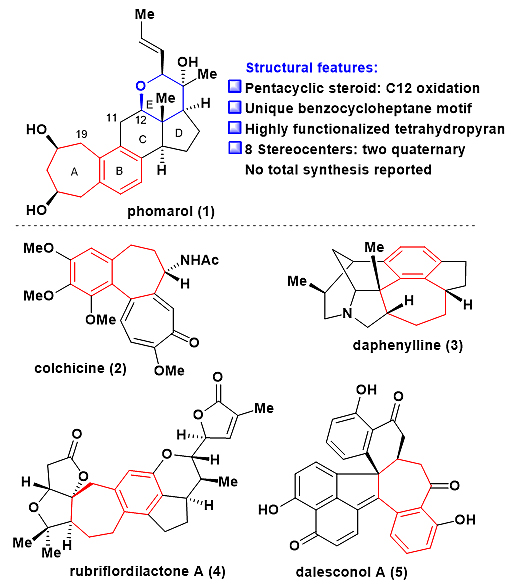
图2. Phomarol的结构特点以及具有苯并七元环的代表性天然产物
作者希望在合成后期根据生源途径 (分子内SN2'环化) 构建四氢吡喃环(图3)。因此,phomarol可以逆推至化合物6。化合物6可以由化合物7和锂试剂8通过1,2-加成反应得到。进而化合物7可由化合物9通过芳构化得到。四环化合物9则由10发生Achmatowicz反应和Type I [5+2]环加成反应制备。最后,作者利用已知化合物12,呋喃化合物11和丁烯基锂试剂通过Stille偶联及1,2-加成反应合成10。
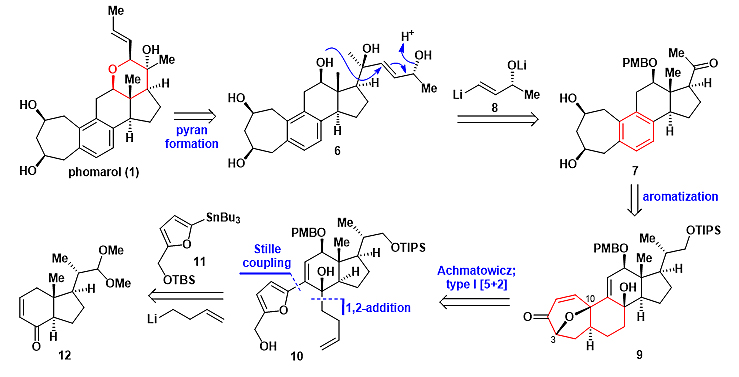
图3. Phomarol的逆合成分析
Phomarol的不对称全合成 (图4-7)
从已知化合物12出发,先脱缩醛,然后DIBAL还原得到二醇14(图4)。接着选择性TIPS保护一级羟基,二级羟基乙酰化得到化合物15。Allylic氧化15得到α构型的C12-OH,再通过Ley氧化和还原翻转C12-OH构型。化合物16中的羟基用PMB保护及脱除Ac一锅法合成17。化合物17通过DMP氧化和碘代得到烯基碘18。18与锡试剂11发生Stille偶联得到19。紧接着,19与相应锂试剂发生1,2-加成和脱TBS得到化合物10。
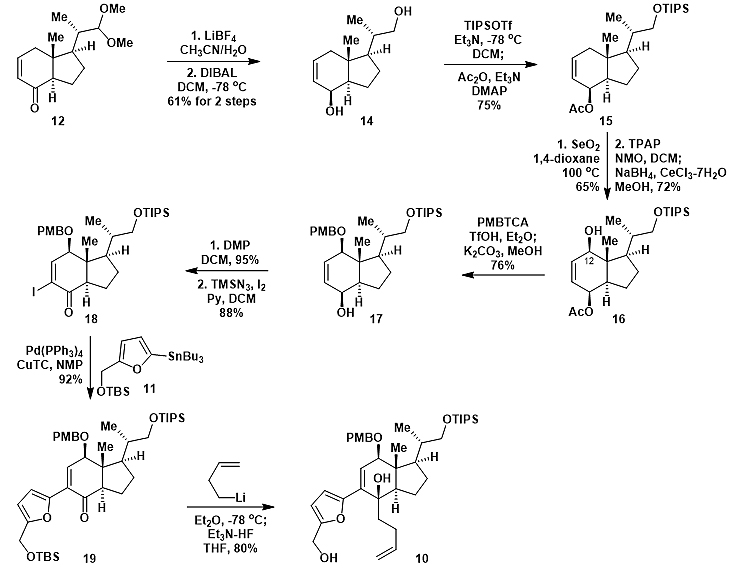
图4. 化合物10的不对称合成
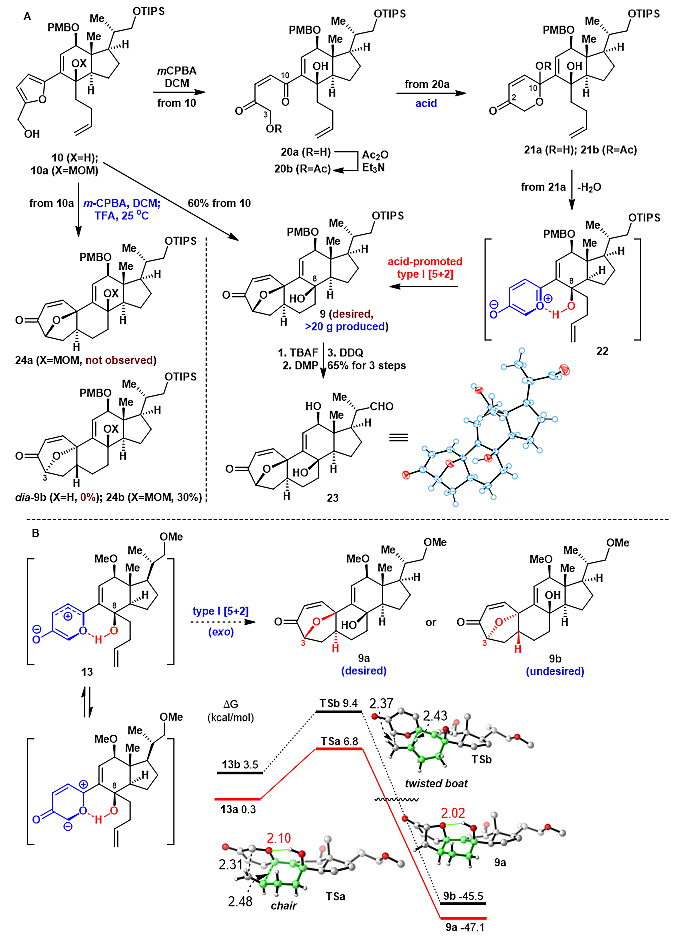
图5. Brønsted酸促进的Type I [5+2]环加成反应
化合物10在m-CPBA的作用下发生氧化重排。意外的是,该重排反应只得到20a,没有得到想要的吡喃酮21a(图5A)。对20a进行乙酰化只有产物20b,经典的[5+2]环加成反应前体21b没有生成。显然,化合物20b不能发生分子内的[5+2]环加成反应。于是,作者设想20a在酸的作用下会生成吡喃酮21a,接着发生脱水消除得到偶极体22,再发生分子内的[5+2]环加成反应。作者通过大量实验发现,化合物10氧化重排完后,在室温下,往稀释的反应体系中加入三氟乙酸(TFA),成功地得到单一的[5+2]产物9,其结构通过衍生物23的单晶确认。尤其值得注意的是,理论计算表明,在模型中间体13中,C8-OH与偶极体之间的氢键控制该[5+2]环加成反应的立体选择性;对于模型中间体13,产物9a既是动力学产物同时又是热力学稳定产物(图5B)。根据理论计算结果,作者推测在中间体22中,同样存在氢键控制该[5+2]环加成反应的立体选择性,从而得到单一产物9,其氧桥构型与天然产物phomarol所需要的C3手性中心一致。为了进一步验证这一结果,作者合成了化合物10a,其C8-OH被MOM保护。10a在相同的实验条件下发生[5+2]环加成反应得到了产物24b,其氧桥构型与天然产物不一致,从而验证了分子内氢键作用控制该[5+2]环加成反应的立体选择性。该研究是首例运用分子内氢键调控环加成反应的立体选择性的报道,为发展新的催化不对称[5+2]环加成反应提供重要的参考。
在成功合成四环化合物9后,作者尝试构建四取代的苯环化合物28(图6)。化合物9在SOCl2/Py条件下发生三级羟基消除,然后一锅法还原羰基得到25。化合物25顺利地发生Barton脱氧反应得到芳构化前体26。化合物26在TMSOTf/2,6-lutidine条件下发生位点选择性的C10-O键断裂,生成中间体27,然后加入4 N HCl,以较好的收率得到芳构化产物28。中间体27在室温和空气条件下极不稳定,无法通过硅胶过柱得到纯品,其结构通过核磁粗谱和高分辨质谱确认。值得注意的是,天然产物phomarol中的苯并七元环结构通过[5+2]环加成/芳构化反应构建,该研究也是首例运用[5+2]环加成/芳构化来构建苯环。随后,28在NBS,THF/H2O条件下发生双键的溴羟化,再用碱处理得到单一环氧产物29。化合物29经区域选择性的开环氧,MOM保护1,3-二醇,脱TIPS保护基得到化合物30。化合物30经两步氧化转化为31。
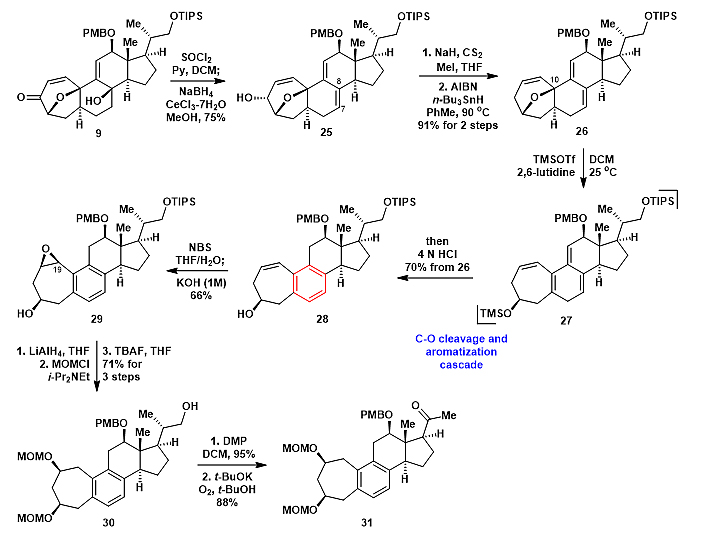
图6. 化合物31的不对称合成
在成功制备化合物31后,剩下的工作就是完成天然产物中四氢吡喃环的合成(图7)。该四氢吡喃环高度官能团化,含有5个连续的手性中心,其中两个为季碳手性中心,如何立体选择性的构建该四氢吡喃环也是本次合成的一大难点。作者首先根据生Jung(phomarol的分离者)提出的生源途径,从化合物34出发,利用酸催化的分子内的SN2'环化来构建吡喃环。然而,作者尝试在各种酸性条件下,均未得到生成四氢吡喃环的产物。因此,作者推测其它的生成四氢吡喃环的生源途径。经过深入的研究与思考后,作者认为环氧化合物35可以作为构建吡喃环的前体,在酸性条件下,化合物35中C12-OH进攻C22,选择性地开环氧,得到四氢吡喃环。为了证实这一可能的生源途径,作者从化合物31出发,先与相应的锂试剂发生加成得到33,然后33在KHMDS和Ts-imidazole的作用下,生成环氧35。化合物35用DDQ脱PMB保护基,释放出的C12-OH立即发生分子内的SN2反应,实现了区域和立体选择性地构建四氢吡喃环。在一锅内,加入盐酸,脱MOM保护基,顺利得到终产物phomarol。并且,phomarol的结构由衍生物37的单晶确认,从而确定了天然产物phomarol的绝对构型。
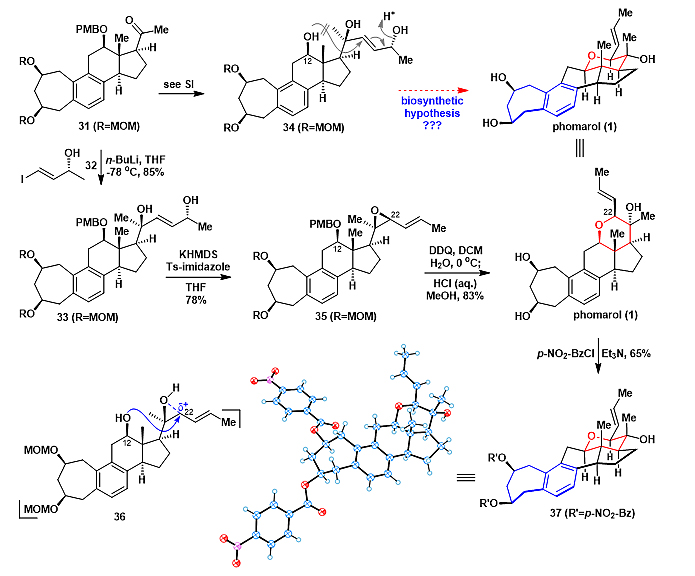
图7. Phomarol的不对称全合成
小结
李闯创教授课题组完成了具有挑战性的新颖甾体phomarol的首次不对称全合成。其工作亮点在于:通过温和的Type I [5+2]环加成反应和选择性切断C-O键/芳构化串联反应,构建苯并七元环,该骨架类型同样存在其他天然产物中;这也是首例运用酸促进的Type I [5+2]环加成反应完成天然产物的全合成;同时,该研究也是首例运用分子内氢键调控环加成反应的立体选择性的报道,为发展新的催化不对称[5+2]环加成反应提供重要的依据。该研究也是首例通过[5+2]环加成/芳构化来构建苯环。此外,该研究为phomarol中四氢吡喃环的构建提供了一条可能的合成生源途径。该项研究使用的合成方法还可以扩展到其它具有苯并七元环的天然产物的不对称合成,为进一步的生物学研究打下了坚实的基础,也为后继开展创新药物的进一步药物化学研究奠定了基础。相关成果以“Asymmetric Total Synthesis of Phomarol”为题,发表在中国化学会旗舰期刊CCS Chemistry 上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric Total Synthesis of Phomarol
Jian-Hong Fan, Jing-Jing Wang, Fangfang Li, Guannan Wang, Qiang Guo, Lung Wa Chung, Chuang-Chuang Li
CCS Chem., 2021, DOI: 10.31635/ccschem.021.202000721
导师介绍
李闯创
https://www.x-mol.com/groups/li-chuangchuang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号