关于SNAr反应,“膦”有话说
芳香亲核取代反应(SNAr)是重要的经典有机化学反应之一。它发生在芳基卤(拟卤)代物和亲核试剂之间,指的是芳环上的一个离去基团被亲核试剂原位取代。由于氟原子的强电负性会使被进攻位点的电子云密度减小,进而加快亲核试剂进攻的速率。所以,F负离子是相对好的离去基团,芳基氟化物是比较好的反应底物。通常情况下,SNAr反应是一个分步过程,具体路径如下:芳基氟化物在接受亲核试剂的进攻后,会得到破芳香的中间体(Meisenheimer络合物),随着离去基团的离去,再重新芳构化得到产物(图1a)。该路径要求芳基氟化物带有强吸电子取代基,这样中间体才能被稳定住。如果芳基氟化物带有富电子或电中性取代基的话,同样可以发生SNAr反应,但它是一个协同路径,又称作CSNAr反应(图1b)。在该路径中,反应过渡态的芳香性没有被完全破坏掉,而且其中的负电荷可以被离散到芳环和氟原子上,所以协同机制的过渡态能垒较低,不需要强吸电子取代基协助降低反应的活化能。一般来说,SNAr反应的机制(分步或者协同)取决于芳基卤代物,与亲核试剂无关。
近日,日本北海道大学的Masaya Sawamura教授(点击查看介绍)和Tomohiro Iwai教授(点击查看介绍)团队对SNAr反应的机制提出了一个与之前不同的新解释:SNAr反应的路径和亲核试剂有关。当双有机亚磷酸钾盐是亲核试剂时,惰性或者富电性的芳基氟化物可以与其发生高效的SNAr反应,生成各种具有潜在合成价值的叔膦氧化物(图1c)。计算表明分步和协同机制都是可行的。相关成果发表在Angew. Chem. Int. Ed.上。

图1.芳基氟化物的芳香亲核取代反应(SNAr)。图片来源:Angew. Chem. Int. Ed.
前文提到,SNAr反应的效率和离去基团有关,图2也验证了这一说法。当离去基团是氟负离子时,反应能够高效发生,并且以优秀的收率得到原位取代产物3a。当离去基团是氯负离子时,反应会得到一对区域异构体(3a & 3b),这说明反应过程中生成了苯炔中间体。当离去基团是溴负离子或碘负离子时,反应仅会得到脱卤副产物。

图2. 离去基团对反应的影响。图片来源:Angew. Chem. Int. Ed.
在该反应中,SNAr反应的效率深受碱的影响(图3)。钾盐(如KHMDS, KOtBu, KH)会大大促进反应的进行;钠盐和锂盐会导致反应活性降低甚至消失;弱碱(如KOMe、K3PO4、K2CO3)和有机碱(DBU)的使用也不利于反应进行。
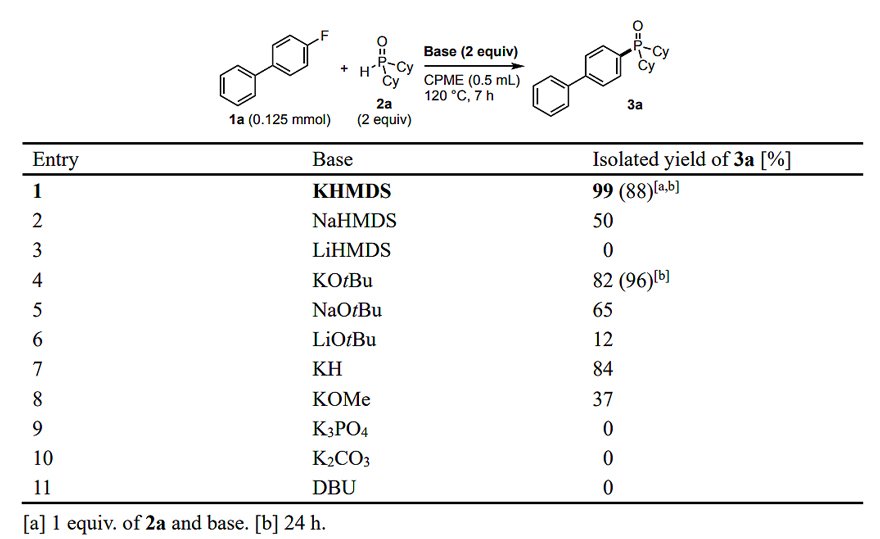
图3.碱效应。图片来源:Angew. Chem. Int. Ed.
在得到最佳反应条件后,作者分别针对芳基氟化物和仲膦氧化物,依次进行了底物普适性的考察(图4)。联芳基氟化物的反应活性普遍不错。1-氟萘、间氟吡啶、二茂铁氟化物都能以优秀或中等的收率得到产物。但是氟苯或4-F-N,N-二甲基苯胺不能得到产物(3l、3m),只有带π体系的氟苯衍生物能够高效转化(3o、3p、3q)。亲核试剂可以是二环己基氧膦、二苯基氧膦、二正丁基氧膦和二叔丁基氧膦。此外,二氟苯能够以良好的收率进行二次SNAr反应,得到双膦氧化物(4a)。

图4. 底物范围的考察。图片来源:Angew. Chem. Int. Ed.
值得一提的是,该方法可以实现芳基氟化物和手性仲膦氧化物的立体专一性反应(图5)。从手性纯的(S)-2e出发,反应能以不错的收率和优秀的对映选择性得到P-手性叔膦氧化物。美中不足的是,作者尝试立体专一性地还原手性膦氧化物,却发现膦手性会消旋化。这说明暂时无法利用该反应实现手性膦配体的合成,也极大地限制了该方法学的应用。

图5. P-手性叔膦氧化物的合成。图片来源:Angew. Chem. Int. Ed.
为了深入了解反应机制,作者尝试分步加料并利用31P NMR随时监测反应(图6),证实该反应分两个过程进行。首先,二环己基氧化膦和KHMDS在120 ℃下发生去质子化,生成白色沉淀,即双有机亚磷酸钾盐K[2a-H]。接着,向体系中加入底物1a, K[2a-H]会和其发生反应,生成亚膦酰化的产物3a。
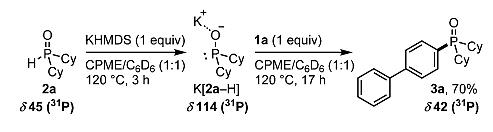
图6. 31P NMR监测反应。图片来源:Angew. Chem. Int. Ed.
鉴于氟离子作为离去基团的重要性,作者认为第二个过程是亲核取代反应。基于该假设,作者对该亲核取代反应的机制进行了密度泛函理论(DFT)计算,并提供了两种合理的反应路径,一种是协同机制(蓝线),另一种是分步机制(红线)。关于协同路径,作者认为双有机亚磷酸钾盐中的钾离子先和芳基氟化物1a中的氟原子络合生成Int1,再经由一个五元环过渡态TS1发生芳香亲核取代反应得到Pro1。而对于分步路径,钾盐先和芳环发生η6-配位得到Int2,再经由TS2得到短寿命的Meisenheimer络合物Int3,脱氟和芳构化紧随其后,经由TS3得到Pro2。最后KF离去就会得到产物3a。之所以该反应能够兼容电中性和富电性芳基氟化物,作者认为一方面亚膦酰基具有吸电子的特性,所以可以分散过渡态中的负电荷,提供了一定的稳定性。另一方面钾盐能够分散氟离子上的负电荷(协同路径)和芳环的负电荷(分步路径)。此外,在分步路径中,氟原子可能既和磷原子有F…P相互作用,又和亚膦酰基中环己基上的氢原子有C-H…F相互作用,所以中间体能够被进一步稳定住。

图7. DFT计算。图片来源:Angew. Chem. Int. Ed.
总结
Masaya Sawamura教授和Tomohiro Iwai教授团队发现,不含有强吸电子基的芳基氟化物和二烷基(芳基)氧化膦可以在强碱性钾盐(如KOtBu、KHMDS)的作用下进行高效的亲核取代反应。计算研究表明,该反应有别于之前的机制,分步和协同路径都是可行的。这和亲核试剂双有机亚膦酸钾盐独特的电子特性密不可分。从反应机制层面来看,这项工作丰富了芳香亲核取代(SNAr)反应的类型,为读者提供了维度更广阔的认知;从反应实用性层面,这项工作操作简单,易于实施,能够高效地实现具有合成价值的(手性)叔膦氧化物的合成。众所周知,含膦化合物既在农药中广泛存在,又因为其独特的电子特性和几何结构在(不对称)催化反应中举足轻重。所以,如何在已有的工作基础上,继续发展SNAr反应,进一步完善底物的拓展,并且将它成功应用到农药、手性催化剂、膦配体的合成中,是一份愿景,也是一项挑战。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Phosphinylation of non-activated aryl fluorides through nucleophilic aromatic substitution at the boundary of concerted and stepwise mechanisms
Zhensheng You, Kosuke Higashida, Tomohiro Iwai, Masaya Sawamura
Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202013544
导师介绍
Masaya Sawamura
https://www.x-mol.com/university/faculty/65808
Tomohiro Iwai
https://www.x-mol.com/university/faculty/65809
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号