不对称催化酮与α-重氮酯同系化反应
注:文末有研究团队简介及本文科研思路分析
重氮化合物与醛或酮的同系化反应是最直接、高效延长碳链或扩环的途径之一,常被用于生物活性分子和复杂天然产物合成中。目前普遍认为该反应是由重氮碳对羰基碳的亲核加成所引发,紧接着经历1,2-基团迁移同时释放出氮气而生成最终产物。Lewis酸在该类反应中表现出优异的催化性能,其不对称催化的醛与重氮化合物同系化反应在过去十年得到了广泛研究(图1a)。相比之下,酮的不对称催化研究则主要集中在环状酮和活化酮(图1b-d),对于链状简单酮,如苯乙酮及其衍生物,分子间不对称催化同系化反应存在较大挑战,有待突破:(1)链状简单酮与α-重氮酯的加成历程反应活性低,反应难以引发;(2)由于反应的加成引发为可逆过程且中间体易于旋转,存在复杂的化学及区域选择性;(3)同时识别链状简单酮及α-重氮酯的前手性面较为困难,这也将决定反应的区域及对映选择性。
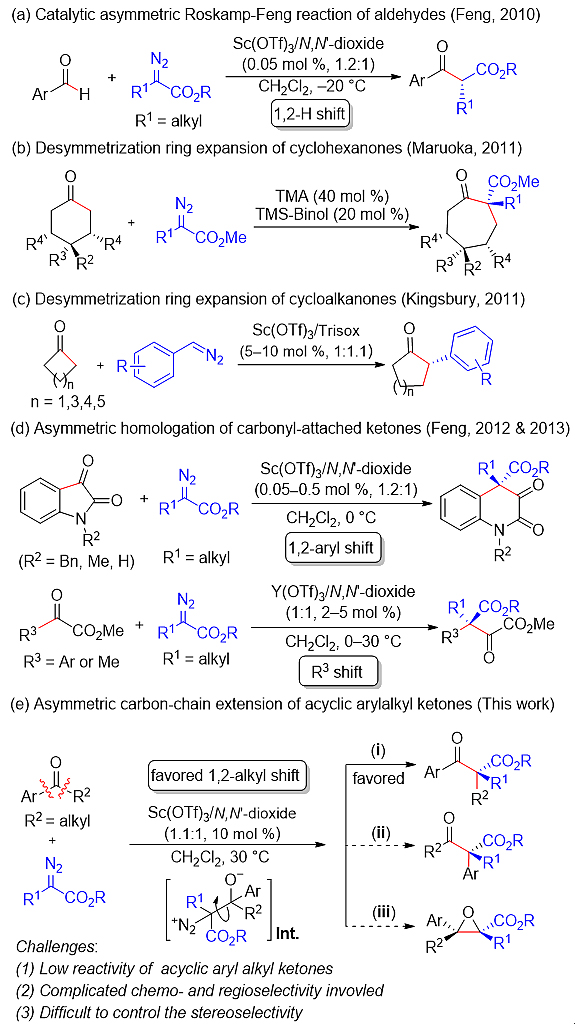
图1. 醛或酮与重氮化合物的不对称同系化反应
近日,基于反应机理和前期工作,四川大学冯小明课题组(化学实验部分)与北京大学深圳湾实验室吴云东课题组(理论计算部分)合作,使用手性双氮氧/钪(III)配合物,实现了首例链状简单酮与α-重氮酯的催化不对称同系化反应,以高收率及出色的区域、化学选择性和对映选择性得到一系列含手性α-季碳中心的β-酮酸酯。此外,经过氮氧配体微调,该催化体系也能很好被运用到非对称环状酮的扩环反应中,以良好的对映选择性生成环状β-酮酸酯。同时,经过密度泛函理论计算,作者提出了链状简单酮的反应历程和优势过渡态。
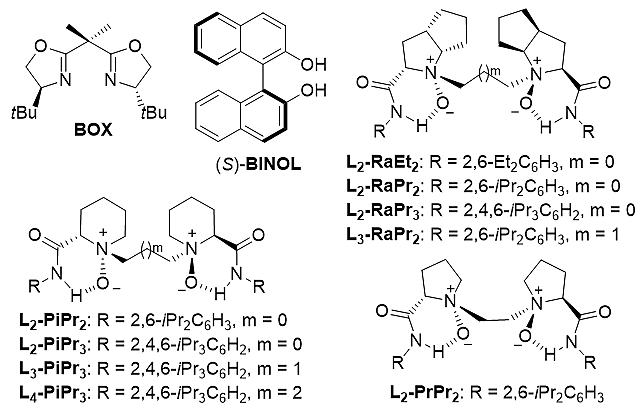
图2. 反应所用手性配体
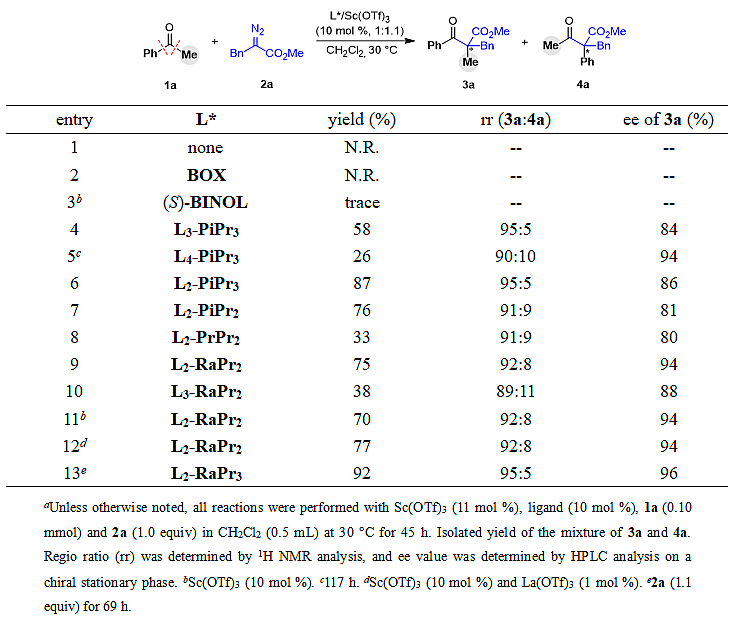
表1. 链状酮反应条件优化a
首先,他们选用苯乙酮1a和α-苄基重氮甲酯2a为模板底物,对链状酮体系进行了条件优化(表1)。通过对配体金属考察,作者发现只有三氟甲磺酸钪/手性双氮氧配合物才能有效促进该同系化反应的发生,在不加氮氧配体或使用双噁唑啉、联萘酚配体时,反应无法顺利进行。同时,缩短氮氧配体的碳链有利于加快反应速率,提高反应收率。其中,两个碳连接的雷米普利衍生的均三异丙基苯胺氮氧配体能给出相对最优结果。此外,作者发现稍过量的金属盐有利于提高反应活性,增加收率(条目9,11,12)。最终,在重氮酯2a稍过量的条件下能以92%的收率、95:5 rr及96% ee得到同系化产物(条目13)。
接着,在该最优条件下,作者首先对该反应体系中α-重氮酯底物进行了考察(表2)。结果表明,该反应体系对α-重氮酯底物普适性广,各类α-苄基-α-重氮酯衍生的底物都能给出良好的收率(69–92%)及出色的区域选择性(92:8–95:5 rr)、对映选择性(90–98% ee)。苄基上的取代基位置及电性对反应活性和选择性有一定影响,其中邻氟取代的底物表现出相对较低的活性且导致反应选择性略微下降。其余位置不同电性取代基主要对反应活性及收率有轻微影响,同时产物3g的绝对构型通过单晶衍射确定为R构型。稠环底物2j也能以标准底物相似的结果得到甲基迁移产物,含烯丙基、炔丙基、苯乙基及乙基的重氮酯底物(2k–2n)同样能给出优异的结果。值得注意的是,高度官能化的底物2o–2r也能以中等到较高收率(35–95%)及良好选择性(83:17–>98:2 rr,76–86% ee)生成目标产物。为验证该反应的实用性,作者以模板反应在标准条件下进行了克级规模放大实验(1a,5.0 mmol,0.60 g;2a,5.5 mmol,1.05 g),结果得到了很好的保持(3a,1.34 g,95%,>95:5 rr,95% ee)。
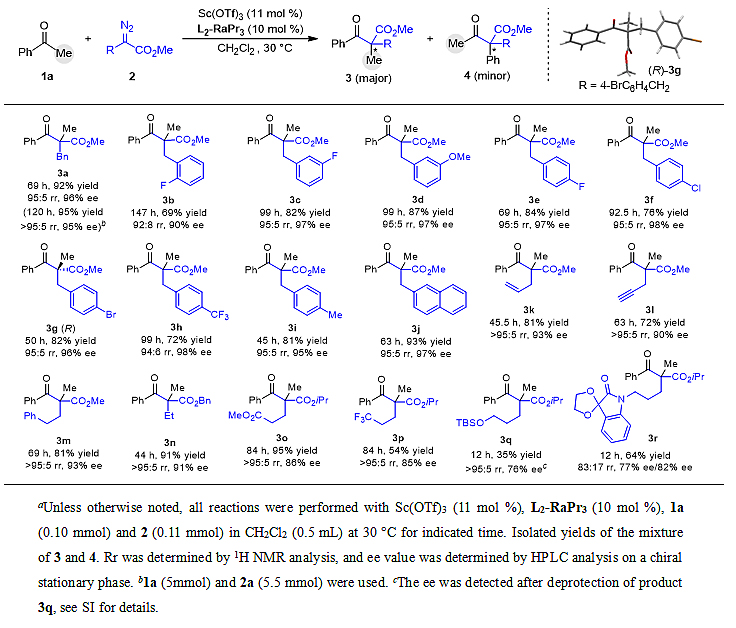
表2. 苯乙酮体系α-重氮酯底物扩展a
随后,作者以3-甲氧基苄基取代的α-重氮甲酯对链状酮底物进行了考察(表3)。结果表明,苯乙酮衍生物的取代基电子及位阻效应对反应结果有较大影响。供电子取代基会降低反应速率,但收率可通过延长反应时间得以提升,而吸电子基取代的底物无明显改善。邻氟取代苯乙酮相比间、对位卤素取代苯乙酮反应速率更慢,收率和选择性相比之下略低(68%收率,82:18 rr,92% ee/72% ee)。值得注意的是,该区域异构体可通过硼氢化钠将酮羰基还原成醇而很好地分开(详见支撑文献)。对氰基苯乙酮表现出更低的反应活性,且反应对映选择性也有所降低(89% ee)。对位供电子取代的对甲基苯乙酮及对甲氧基苯乙酮能给出标准底物相似结果,由于对甲氧基苯乙酮反应活性相对较低,反应时间需适当延长以获得满意收率(116.5小时,89%收率)。含较强配位基团的对甲硫基苯乙酮也能顺利反应并以中等收率(73%)及良好选择性(94:6 rr,97% ee/79% ee)得到同系化产物。稠环的2-萘苯乙酮及杂环的2-呋喃、2-噻吩乙酮都能以较高收率和选择性生成目标产物。此外,不饱和的肉桂酮和4-苯基丁炔酮也能很好适用于该催化体系。对于更简单的丙酮底物,反应也能以高收率(90%)及较低对映选择性(39% ee)得到去对称化产物。值得一提的是,经过简单更换氮氧配体,苯丙酮5o也能成功发生同系化反应,以中等收率(54%)及选择性(75% ee)得到乙基迁移产物。他们也考察了其它烷基取代的链状酮底物,例如1-苯基-1-丁酮,但大多都表现出极低的反应活性(详见支撑文献)。
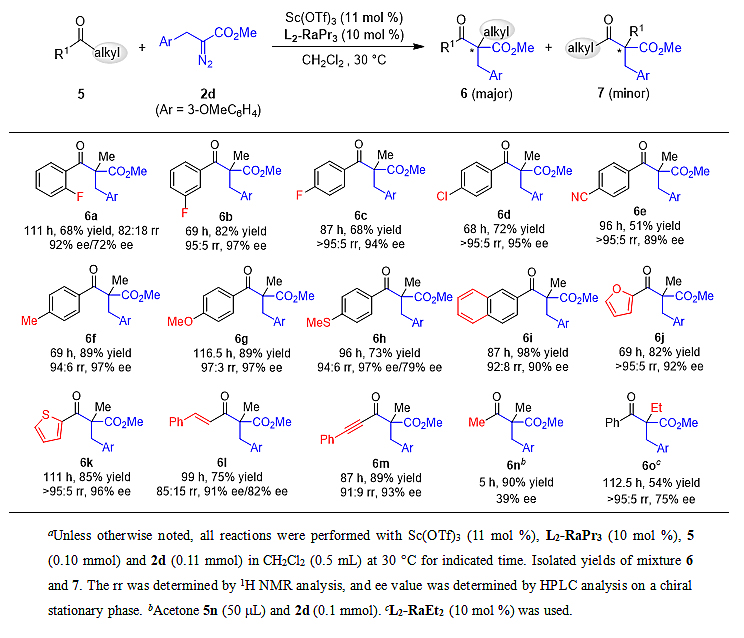
表3. 链状酮底物扩展a
基于链状酮的结果,作者展开了非对称环状酮的研究。首先,作者选用苯并环丁烯酮8a和α-苄基重氮乙酯2s作为模板底物对反应进行了探索(表4)。他们发现,在使用Sc(OTf)3/L2-RaPr2时反应能以55%收率及63% ee得到烷基迁移扩环产物9a,同时也检测到芳基迁移扩环的产物10a,但10a与其它副产物具有相似极性而难以分离纯化。当换用L2-PiPr3时,烷基迁移产物9a的ee值显著提升(82% ee)。当延长连接双氮氧配体的碳链时,烷基迁移的对映选择性进一步提高,但收率呈下降趋势(条目2–4),其中氮氧配体L4-PiPr3能以34%收率及90% ee得到9a。最终,通过使用α-苄基重氮甲酯2a、1.5当量苯并环丁烯酮8a及11 mol %三氟甲磺酸钪,反应能以52%收率及92% ee得到烷基迁移扩环产物9b,进一步的条件考察未能给出更优结果(详见支撑文献)。
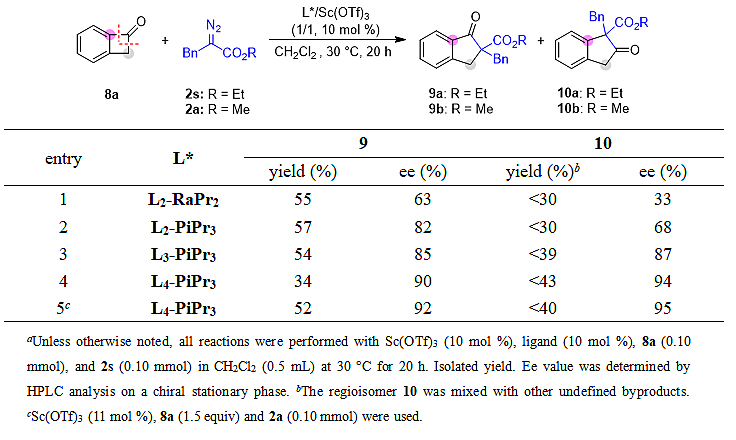
表4. 环状酮体系反应条件优化a
在建立最优条件后,作者对环状酮体系底物普适性进行了考察(表5)。由于绝大部分芳基迁移产物(10或13)和其它副产物具有相似极性,难以分离纯化,故主要分离纯化了烷基迁移扩环的产物(9或12)。其中,邻氟取代的α-苄基重氮甲酯表现出更低的反应活性,所得烷基迁移产物(9c)的收率及ee值也有所降低(39%收率,85% ee),同时,芳基迁移扩环的产物10c也能成功分离纯化(46%收率,91% ee),两产物的绝对构型通过单晶衍射确认为R构型。其它底物的烷基迁移产物具有与9c相似的圆二色谱信号(详见支撑文献)。其它取代的α-苄基重氮甲酯都能以中等收率(37–47%)及优异的对映选择性(90–92% ee)得到烷基迁移产物9。此外,稠环的2-萘取代α-重氮甲酯也能很好适用于该催化体系(9n,42%收率,92% ee)。对于含不饱基团如烯丙基、炔丙基的重氮酯底物,反应也能顺利进行(9o,9p)。其余α-重氮酯底物,如苯乙基、十二烷基及甲基取代的α-重氮甲酯表现出更高的反应活性,都能以中等收率及良好的对映选择性生成烷基迁移产物(21–51% 收率, 89–92% ee)。受限于底物合成,仅一部分代表性的环状酮得以考察。其中,各种取代的6-烷氧基苯并环丁烯酮都能顺利发生扩环反应,以中等收率(50–64%)及高对映选择性(90–97% ee)生成烷基迁移产物12a–12d。5,6-二甲氧基苯并环丁烯酮的反应活性较低,但通过微调氮氧配体结构(缩短连接双氮氧结构的碳链至两碳单元)能很好实现同系化历程(12c,50%收率,90% ee)。根据已有文献报道,五元环状酮在该类反应中活性更低,具有较大挑战性,但在该催化体系中(使用两碳单元连接的氮氧L2-PiPr3)仍能以中等收率(60%)及良好的选择性(91:9 rr,88% ee)生成扩环的1-四氢萘酮衍生物12e。值得注意的是,对于之前报道的1-茚酮的α-氨基化反应产物并没有被检测到,这可能是由于氨化体系所用配体不同及其碱性条件所致。此外,3-苯基环丁烯酮也能以中等收率(60%)和对映选择性(52% ee)生成扩环产物12f,而对称的环丁酮则能以较高收率(86%)和较低ee值(38% ee)得到去对称化产物12g。然而,1-四氢萘酮、环戊酮及环辛酮等酮类在该催化体系下呈现出一定的惰性(详见支撑文献)。另外需要注意的是,产物9b及12g的绝对构型是通过与已有文献报道的旋光数据对比确定。
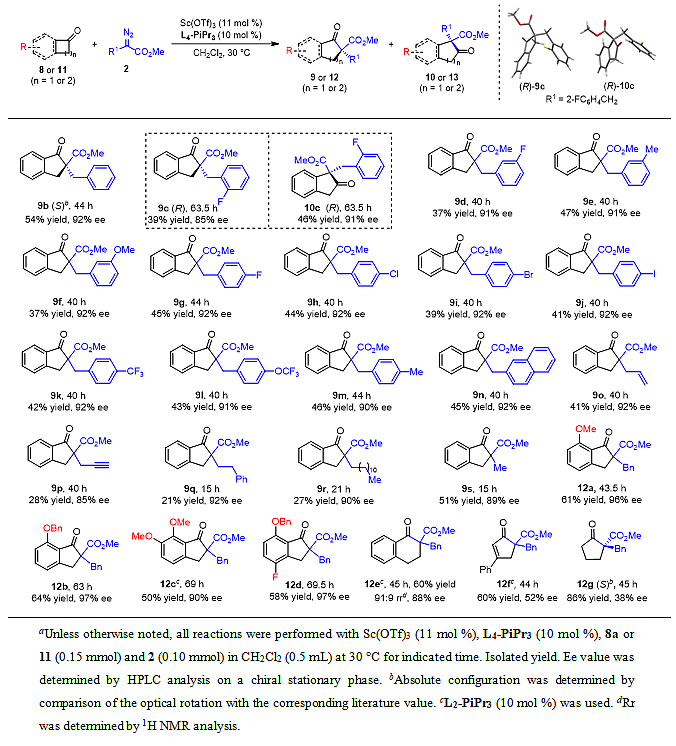
表5. 环状酮体系底物扩展
最后,为了更好地理解该反应的机理,作者进行了密度泛函理论计算。他们发现尽管前期工作有成功得到并解析过钪(III)与该类手性双氮氧及水分子配位形成的配合物单晶(图3),但将配位的水分子替换成苯乙酮时形成的配合物能量更低、更稳定(详见支撑文献)。同时,当手性配合物在识别苯乙酮前手性面(Re及Si面)时存在较低的能量差(0.8 kcal/mol),因此在后续计算中作者将这两种配位模式都考虑了进去(图3)。此外,作者通过计算也排除了α-重氮酯的酯基与钪(III)配位可能性(详见支撑文献)。
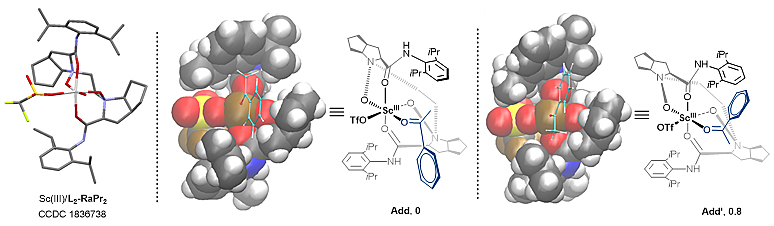
图3. 苯乙酮与钪(III)/氮氧配合物的两种配位模式
基于上述两种苯乙酮配位模型(Add及Add′),作者进一步展开模拟计算。α-重氮酯对这两种模型的配合物亲核加成,经过过渡态TS1形成了一系列中间体(图4)。随后,中间体的碳-氮键断裂(TS2),释放出氮气的同时烷基发生迁移,从而生成最终产物,而这一历程也是该反应的速率决定步骤。这也与苯乙酮苯环上不同电性取代基对反应结果影响相一致,尽管吸电子取代基会增强酮羰基亲电性使得加成过程更容易,但也会导致相应中间体更不稳定,从而整体上并不能加速反应进行。主要产物3a是由过渡态TS2R转化而来,该过渡态中即将离去的氮气与迁移基团甲基处于反式共平面,氮气离去的同时,甲基发生迁移,为协同历程。同时,α-重氮酯的酯基及重氮基团与氮氧配体芳基间的位阻排斥作用得以避免。而芳基迁移产物4a则是由过渡态TS2PhR转化而来,该过渡态中即将离去的氮气朝向金属/氮氧配合物,同时α-重氮酯的酯基及重氮基团与氮氧配体芳基间存在位阻排斥作用(能垒比TS2R高2.6 kcal/mol)。对于次要异构体产物3a′,它是通过α-重氮酯与Add′的加成,由过渡态TS2S转化而来。
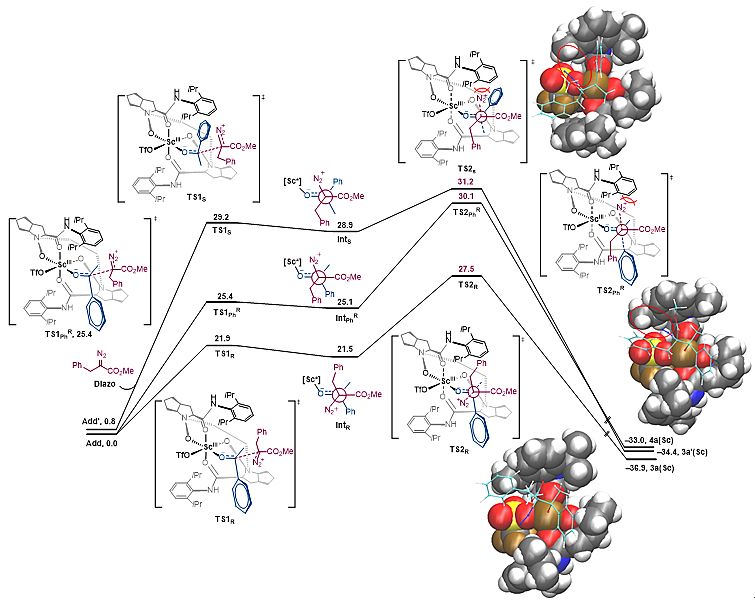
图4. 生成3a(R),4a(R)及3a′(S-3a)的反应历程及过渡态模拟计算
这一成果近期发表在J. Am. Chem. Soc.上,前四川大学博士研究生谭飞及北京大学深圳湾实验室副研究员蒲茂坪为该文章的共同一作。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Asymmetric Homologation of Ketones with α-Alkyl α-Diazo Esters
Fei Tan, Maoping Pu, Jun He, Jinzhao Li, Jian Yang, Shunxi Dong, Xiaohua Liu*, Yun-Dong Wu*, Xiaoming Feng*
J. Am. Chem. Soc., 2021, 143, 2394–2402, DOI: 10.1021/jacs.0c12683
冯小明教授简介

冯小明,中国科学院院士,英国皇家学会会士,四川大学化学学院教授,博士生导师。1988年获兰州大学理学硕士学位,1996年获中国科学院理学博士学位,1998年至1999年于美国Colorado State University化学系做博士后研究,2000年至今就职于四川大学化学学院。历任教育部长江学者特聘教授,国务院政府特殊津贴获得者,国家杰出青年科学基金获得者,国家创新研究群体学术带头人,国家人事部等七部委“新世纪百千万人才工程”入选者,教育部“长江学者和创新团队发展计划”创新团队学术带头人,教育部《跨世纪优秀人才培养计划》入选者,国务院学位委员会学科评议组成员,四川大学学术委员会委员,四川大学学位委员会委员,中国化学会有机化学学科委员,任Advanced Synthesis & Catalysis、Asian Journal of Organic Chemistry、Current Organic Synthesis、Synlett、Synthesis、Chinese Chemical Letters、应用化学、结构化学顾问编委,任Chemistry–An Asian Journal、《有机化学》、《无机化学学报》编委。主要从事新型手性催化剂的设计合成、不对称催化反应、手性药物和生理活性化合物的高效高选择性合成研究。独立工作至今已在Acc. Chem. Res., Chem. Rev., Chem. J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal., Nat. Commun., Chem. Sci., Chem. Eur. J., Org. Lett.等刊物上发表论文400多篇。研究成果入选了“2011年中国高等学校十大科技进展”,中科院2012《科学发展报告》和《国家自然科学基金资助项目优秀成果选编》。2009年获教育部高等学校科学研究优秀成果奖自然科学一等奖(第一完成人);2010年获国家自然科学基金委创新研究群体资助(学术带头人);2010年获药明康德“生命化学奖”二等奖;获中国化学会有机化学委员会颁发的“有机合成创造奖”、获全国优秀博士学位论文指导教师荣誉称号;2012年获国家自然科学奖二等奖(第一完成人);2013年当选中国科学院院士;2014年当选英国皇家化学会会士;2016年获中国化学会“手性化学奖”;2018年获未来科学大奖物质科学奖,中国化学会黄耀曾金属有机化学奖;2019年获教育部高等学校科学研究优秀成果奖自然科学一等奖(第一完成人),何梁何利基金科学与技术进步奖,四川杰出人才奖;2020年获陈嘉庚科学奖化学科学,全国创新争先奖(个人奖章),全国杰出教学奖。
https://www.x-mol.com/university/faculty/12766
科研思路分析
Q:这项研究的最初目的是什么?或者说想法是如何产生的?
A:酮与α-重氮酯的不对称同系化反应是构建手性季碳中心的高效策略,被广泛运用于生物活性分子和天然产物合成中。尽管近年来活化酮的同系化反应已有较大发展,但对于非活化链状酮的研究因其反应活性低等因素未能取得实质性的进展,仍需突破。因此,基于前期工作的积累及对反应机理的深入理解,通过选取合适手性Lewis酸来活化简单链酮实现其与α-重氮酯的不对称同系化反应的想法应运而生。
Q:在研究过程中遇到的最大挑战在哪里?
A:简单链酮的反应活性比环状酮、α-酮酸酯等活化酮低很多,反应难以发生。因此,如何提高简单链酮反应活性是该研究过程中面临的最大挑战。幸运的是,通过调节手性双氮氧配体的结构及对常用Lewis酸金属盐的仔细考察,简单链酮的反应活性问题最终得以解决。
Q:本项目的不足和未来发展空间可能在哪里?
A:对于简单链酮体系,其酮底物局限性比较明显,芳基-甲基酮类底物反应结果较好,其它芳基-烷基酮、烷基-烷基酮类底物反应结果较差,反应活性很低。对于非对称环状酮体系而言,一方面,与简单链酮体系类似,其酮底物局限性也比较明显,仅对于苯并环丁烯烃类底物才能得到较好的对映选择性;另一方面,其区域选择性并不理想,烷基迁移和芳基迁移扩环产物比例接近,且大部分情况下芳基迁移产物与其它副产物难以分离,不能得到纯品。因此,如何进一步拓宽这两体系中底物类型及提高非对称环酮反应的区域选择性将是值得深入研究的方向。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号