JACS:(+)-peniciketals A和B的首次全合成
Peniciketals A-C是滨州医学院的王春华教授和山东大学的朱荣秀教授等人在2014年从渤海湾盐碱地土壤中的雷斯青霉菌中所分离出的天然产物。他们进一步研究发现,该天然产物家族表现出针对白血病细胞和肺癌细胞较好的抑制活性。同时该天然产物也表现出对正常人体细胞较弱的毒性,因此对癌细胞的抑制有高选择性的特点,使其成为一类潜在的细胞增殖抑制剂或抗肿瘤剂。Peniciketals家族的天然产物拥有新颖的苯并螺环缩酮和苯并桥环缩酮的骨架,在合成上颇具挑战性。最近,美国宾夕法尼亚大学的Amos B. Smith, III教授(点击查看介绍)团队成功报道了(+)-peniciketals A-B的全合成工作,关键的合成转化包括I型阴离子接力化学(ARC)构建苯并[6,6]-螺环缩酮,Negishi偶联/烯烃复分解反应序列构建反式-烯酮结构以及Smith组新发展的光致异构化/环化的大分子片段偶联反应来构建关键的苯并桥环缩酮的骨架。相关研究成果发表在JACS上,第一作者是Smith教授的博士生Yifan Deng。
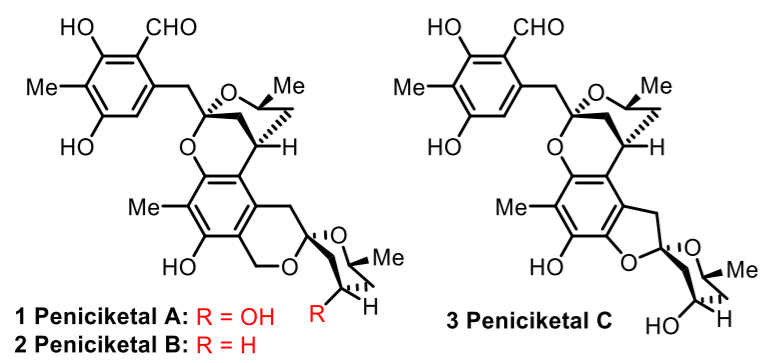
图1. Peniciketals A-C的结构。图片来源:J. Am. Chem. Soc.
光致异构化/环化偶联反应是基于Smith团队2015年发表的光致异构立体选择性合成螺环缩酮反应扩展而来的。作者设想在355纳米的紫外光下,反式-烯酮会异构成顺式-烯酮,在酸性环境下,顺式-烯酮会环化脱水得质子形成氧𬭩离子中间体D。通过加入亲核试剂,例如苯酚,则可以与中间体D发生[3+3]环加成反应,高立体选择性得到理想的苯并桥环缩酮结构E。
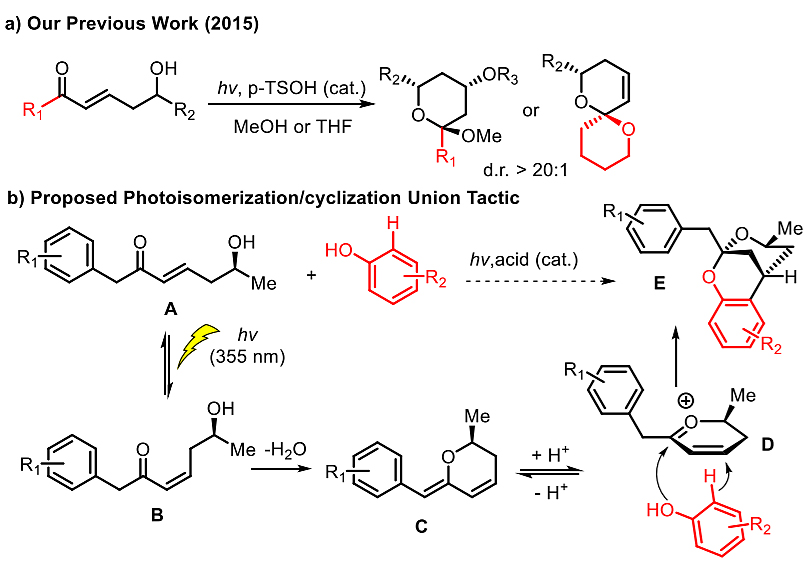
图2. 光致异构化/环化反应。图片来源:J. Am. Chem. Soc.
作者首先对Peniciketals A进行了逆合成分析,通过光致异构化/环化的策略可以分解为南北两个片段:反式-烯酮4和苯并[6,6]-螺环缩酮5。反式-烯酮4可以通过两步的Negishi偶联/烯烃复分解反应序列由6-8来构建,而苯并螺环缩酮5可以通过其线性前体9环化所得。线性前体9具有1,3,5-三羟基的结构,可以通过I型阴离子接力化学(ARC)由10-12偶联而得。
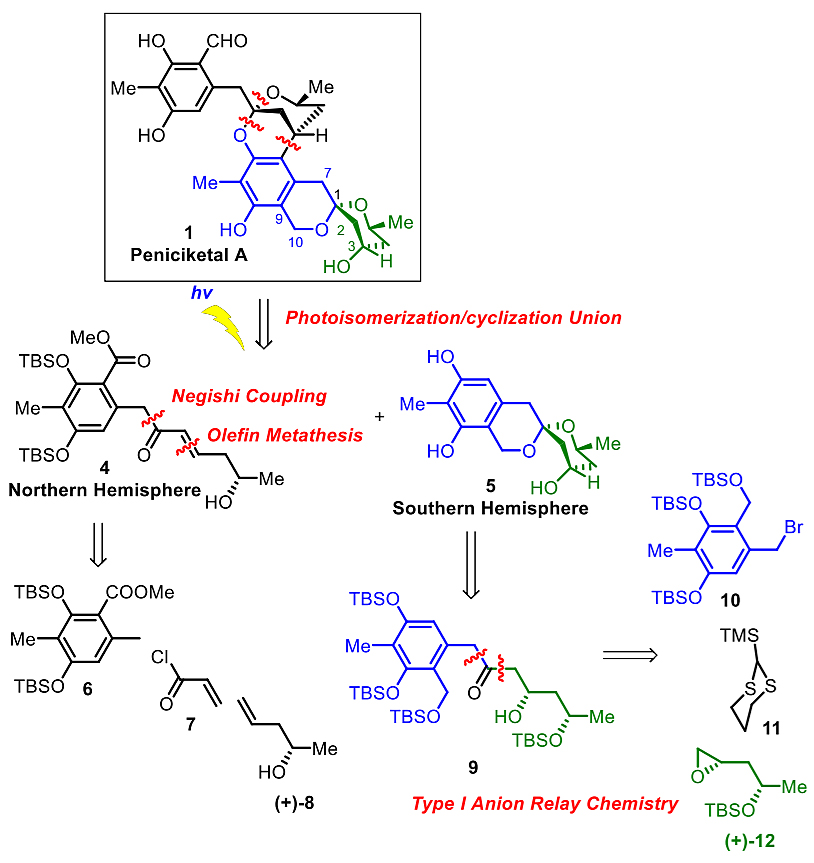
图3. 逆合成分析。图片来源:J. Am. Chem. Soc.
作者首先用反式-烯酮(+)-13和间二苯酚14进行了模型研究。他们发现在355 nm的紫外光下用对甲苯磺酸(PTSA)做催化剂可以以45%的收率拿到理想的产物(+)-15,并具有>20:1的立体选择性。作者同时分离出了中间体(+)-16,且将(+)-16重新投入酸性条件下,能在无光照条件下得到产物(+)-15,这支持了他们提出的反应机理。作者进一步优化条件,在较高浓度下使用樟脑磺酸 (CSA) 能将产率提高到80%。控制实验表明,在没有光的情况下,该反应无法发生。
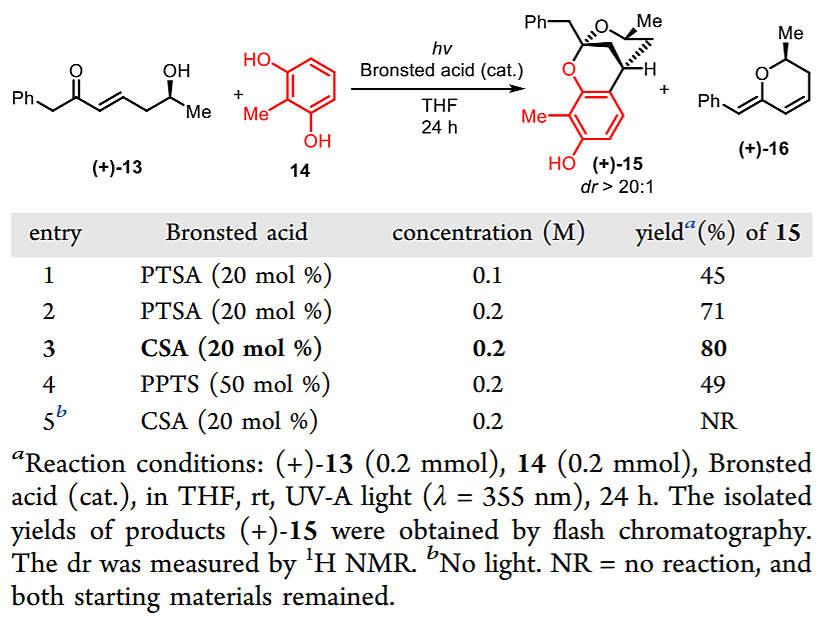
图4. 模型研究。图片来源:J. Am. Chem. Soc.
作者接着对苯并[6,6]-螺环缩酮5进行了合成研究。I型阴离子接力化学(ARC)所需的多取代苄溴10可以由商业可得的羧酸17通过8步反应合成。利用Brook重排反应,TMS-二噻烷11、环氧(+)-12和苄溴10能够在一锅的情况下进行阴离子接力化学,从而实现三组分偶联。随后在高氯酸汞/碳酸钙作用下同时进行二噻烷和TMS保护基的消除反应,能以2克反应规模64%的分离产率得到中间体(+)-9。随后,他们使用四氯金酸钠做催化剂,同时进行两个烷基TBS醚的脱保护和高立体选择性的螺环化反应,得到具有苯并[6,6]-螺环缩酮结构的中间体(-)-22。脱去两个酚羟基上的TBS基团顺利得到了苯并[6,6]-螺环缩酮(-)-5。
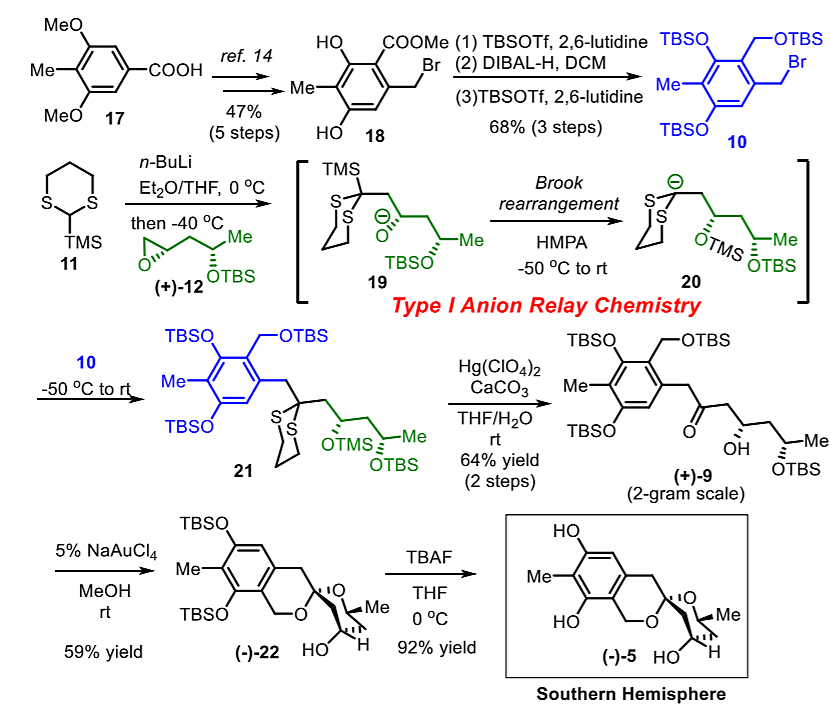
图5. 苯并[6,6]-螺环缩酮5的合成。图片来源:J. Am. Chem. Soc.
作者随后从天然酚类酯23出发对反式-烯酮4进行了合成。用新制的THP-Li试剂对TBS保护的23脱质子,可以得到在低温下稳定的阴离子中间体24,通过与二氯化锌转金属,在四三苯基膦钯的催化下能与酰氯7发生Negishi偶联,从而以80%产率的到烯酮25。在Hoveyda−Grubbs II催化剂的作用下,25与高烯丙基醇(+)-8能反应得到反式-烯酮4。
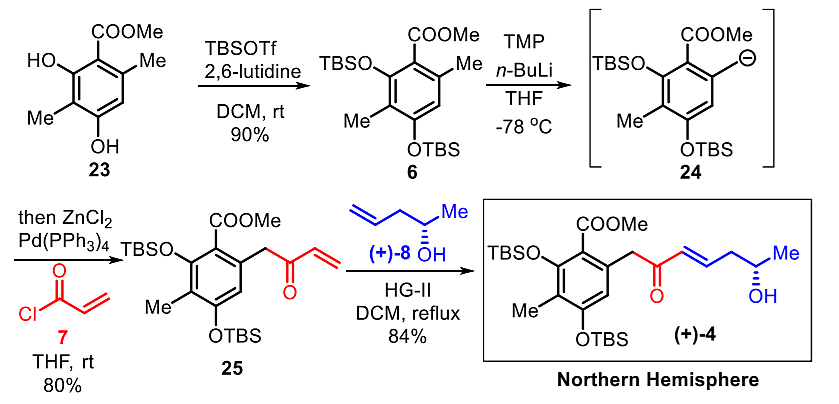
图6. 反式-烯酮4的合成。图片来源:J. Am. Chem. Soc.
顺利得到中间体反式-烯酮(+)-4和苯并[6,6]-螺环缩酮(-)-5后,作者紧接着利用上述光致异构化/环化策略进行(+)-4和(+)-5的偶联。(+)-4在紫外光的作用下异构环化得到中间体26。(-)-9在CSA的催化下与其发生[3+3]环加成,顺利以72%的产率立体选择性地得到(-)-27。随后通过TBS保护,DIBAL-H还原,Dess-Martin氧化,脱TBS的反应序列最终顺利的合成了天然产物(+)-peniciketal A。
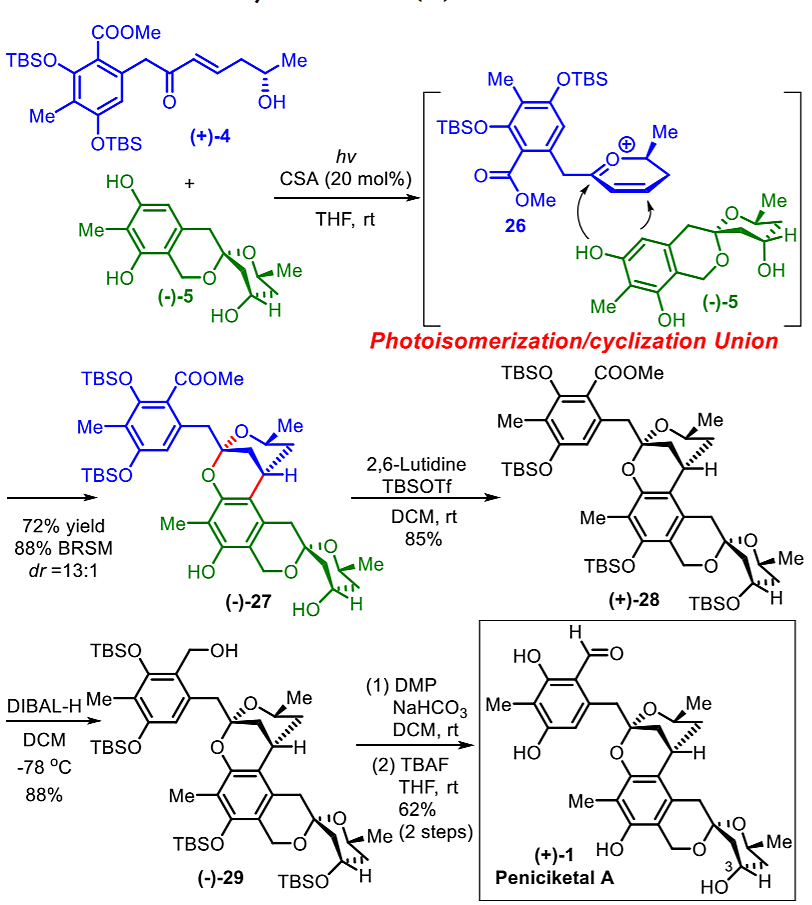
图7. (+)-Peniciketal A的合成。图片来源:J. Am. Chem. Soc.
顺利合成了(+)-peniciketal A后,作者紧接着进行了(+)-peniciketal B的合成。作者从中间体(-)-22出发,通过Barton-McCombie去氧反应,在脱掉TBS后成功得到可以用于合成(+)-peniciketal B 的苯并[6,6]-螺环缩酮中间体(-)-31。在历经了同样的光致异构化/环化反应,以及还原/氧化的处理之后,作者顺利合成了天然产物(+)-peniciketal B。
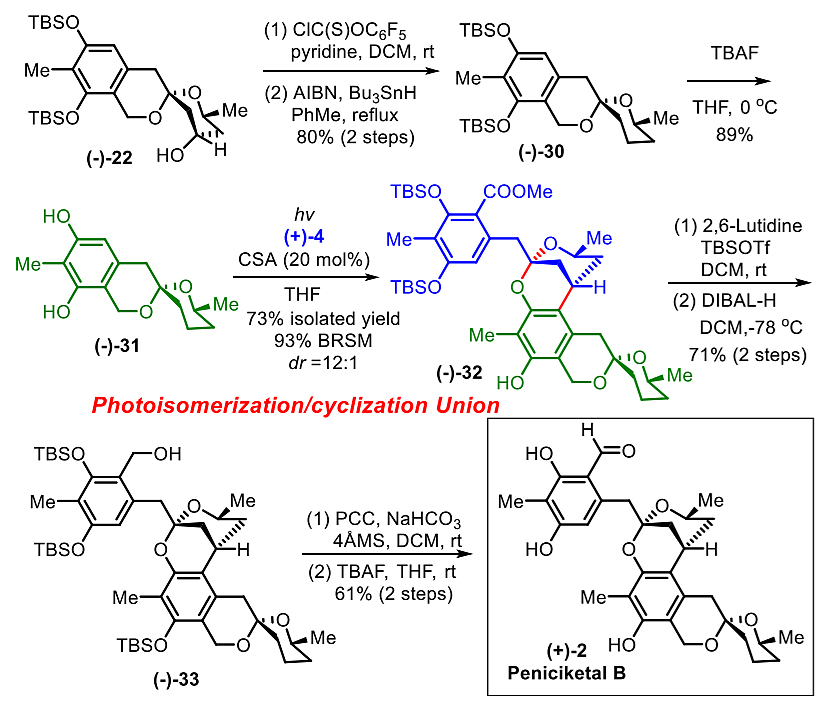
图8. (+)-Peniciketal A的合成。图片来源:J. Am. Chem. Soc.
作者还进一步对(+)-peniciketal A和B进行了生物活性测试。他们先使用两组肺癌细胞A549和H1975进行细胞测试,发现peniciketal A对两组细胞的IC50分别为16.4和14.3 μM。而peniciketal B具有更高的毒性,IC50分别为6.8和7.3 μM。作者还有正常人体肺细胞IMR90验证了peniciketal A和B确实对正常细胞的毒性较低。
总结
Amos B. Smith III教授团队报道了(+)-peniciketal A和B的首次不对称全合成,最长线性步骤为17步。工作的两点是反应过程中利用I型的ARC反应构建苯并螺环缩酮前体,用新发展的光致异构化/环化反应构建苯并桥环缩酮股价。目前作者正致力于peniciketal家族其他天然产物,以及类似化合物的合成和其生物活性的研究。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Total Synthesis of (+)-Peniciketals A and B: Two Architecturally Complex Spiroketals
Yifan Deng, Chia-Ping H. Yang, Amos B. Smith III*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.0c11424
导师简介:
Amos B. Smith III
https://www.x-mol.com/university/faculty/1372
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!











































 京公网安备 11010802027423号
京公网安备 11010802027423号