镍催化酰胺的还原芳基化反应
众所周知,羧酸衍生物是一类重要的有机化合物,亲核加成主要有两种机理(图1a)。传统的策略是通过四面体中间体产生羰基衍生物的加成-消除,但是该策略存在一定的局限性,这是因为生成的酮产物很容易再次与亲核试剂进行加成,产生非手性醇产物,因此需要特殊的酰基衍生物(如N-甲基-N甲氧基酰胺、“ Weinreb酰胺”)来避免该过程,并需要两步操作。另一种方法基于过渡金属催化,生成酰基-金属(acyl-metal)中间体,从而可以与多种亲核试剂进行交叉偶联反应。值得一提的是,如果向最初的交叉偶联反应中间体中添加另一种亲核试剂,便可得到手性产物。
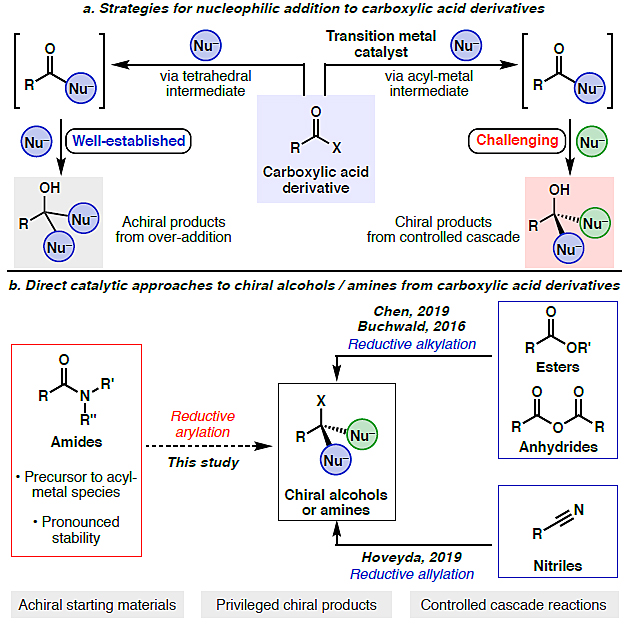
图1. (a)亲核加成到羧酸衍生物的常见反应途径。(b)由羧酸衍生物直接催化制取手性胺或醇的方法。图片来源:Angew. Chem. Int. Ed.
然而,这一过程却存在不小的挑战。2019年,陈宜峰等人报道了芳基吡啶基酯的还原烷基化反应(图1b,Org. Lett., 2019, 21, 2453–2458),机理上涉及酰基-金属物种,是羧酸衍生物通过交叉偶联方法直接与两个亲核试剂进行加成的目前唯一报道。此外,2016年,Buchwald等人报道了铜催化的对称酸酐的还原烷基化反应(J. Am. Chem. Soc., 2016, 138, 5821–5824),得到了一系列光学纯的仲醇,2019年,Hoveyda等人报道了铜催化的腈不对称还原烯丙基化反应(Science, 2019, 364, 45–51,点击阅读详细),生成了一系列光学纯的高烯丙基胺。在此前研究基础上,美国加州大学洛杉矶分校(UCLA)的Neil K. Garg教授(点击查看介绍)课题组设想能否通过一锅法将两种不同的亲核试剂加成到羰基衍生物上?近日,他们报道了镍催化酰胺的还原芳基化反应(图2),即通过一锅法(Suzuki-Miyaura交叉偶联/转移氢化)将酰胺转化为手性醇,相关成果发表在Angew. Chem. Int. Ed. 上。
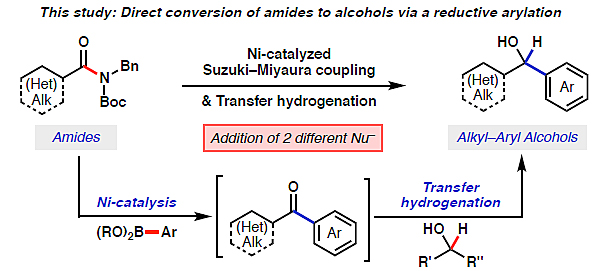
图2. 通过Suzuki-Miyaura偶联/转移加氢串联将脂肪族酰胺转化为手性醇。图片来源:Angew. Chem. Int. Ed.
首先,作者选择二氢肉桂酸衍生的酰胺1作为模板底物来研究Ni-催化的Suzuki-Miyaura偶联和原位还原反应(图3)。在没有还原剂的情况下,底物1与硼酸酯5能够以几乎定量的收率进行Suzuki-Miyaura偶联反应,得到酮3(entry 1)。为了开发合适的还原剂(既不会阻碍Suzuki-Miyaura偶联反应,但又具有足够的反应性来还原酮),作者联想到Meerwein–Ponndorf–Verley (MPV) 反应的还原条件,于是尝试用i-PrOH作为溶剂。郁闷的是,目标产物4的产率较低。随后,作者使用甲苯作为溶剂,同时使用i-PrOH作为添加剂,能以32%的收率得到所需的产物4,同时得到18%的酮3。鉴于1-4-(二甲基氨基)苯基)-1-乙醇(DMPE,7)在碱催化的MPV还原反应中具有较好的效果,因此他们尝试用7代替i-PrOH,结果以51%的收率得到醇4。最后,将溶剂换为1,4-二氧六环,并使用硼酸酯6代替硼酸酯5,最终以82%的产率得到醇4。
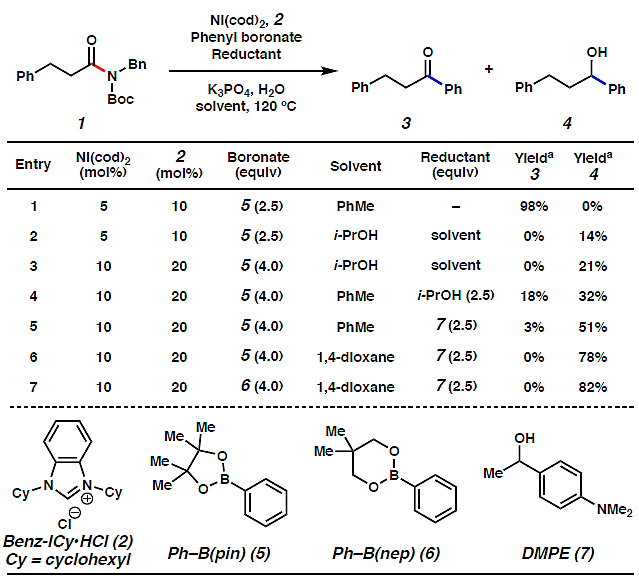
图3. 反应条件优化。图片来源:Angew. Chem. Int. Ed.
在最优条件下,作者考察了脂肪族酰胺的底物范围(图4)。二氢肉桂酸衍生的酰胺1能够有效地进行还原芳基化反应,以76%的分离产率得到醇4,而衍生自癸酸的直链酰胺则以82%的产率得到醇8。对于位阻较大的底物,还原芳基化反应需要在130 ℃下进行,最终以61%的产率得到醇9。接着,作者考察了碳环酰胺的兼容性,结果显示以良好的收率(64-81%)得到醇10–14;考察了杂环化合物的耐受性,其中在药物化学中十分重要的四氢吡喃类、吡咯烷类和哌啶类酰胺都能兼容该反应,以较好的收率(73-84%)得到醇16-20。此外,作者还考察了一种特殊的酰胺底物,该底物带有可发生差向异构化的α-手性中心,并由相应的trans-酰胺底物形成醇15(收率:70%)。值得注意的是,底物上的酯部分并未受到干扰,这表明酰胺C–N键优先于酯基C–O键裂解,同时也表明还原条件相当温和。
为了进一步提高还原芳基化反应的效率,作者进行了筛选以评估反应与各种官能团和杂环化合物的相容性。结果表明叔醇(22)、仲苯胺(23)和仲酰胺(24)等官能团都能耐受该反应,以中等至良好的收率得到目标产物20,且22-24还能以较高的收率回收。另外,喹啉(25)、二苯并呋喃(26)和N-甲基吲哚(27)等杂环化合物也能在标准条件下稳定存在,且对反应的抑制作用很小或几乎没有。
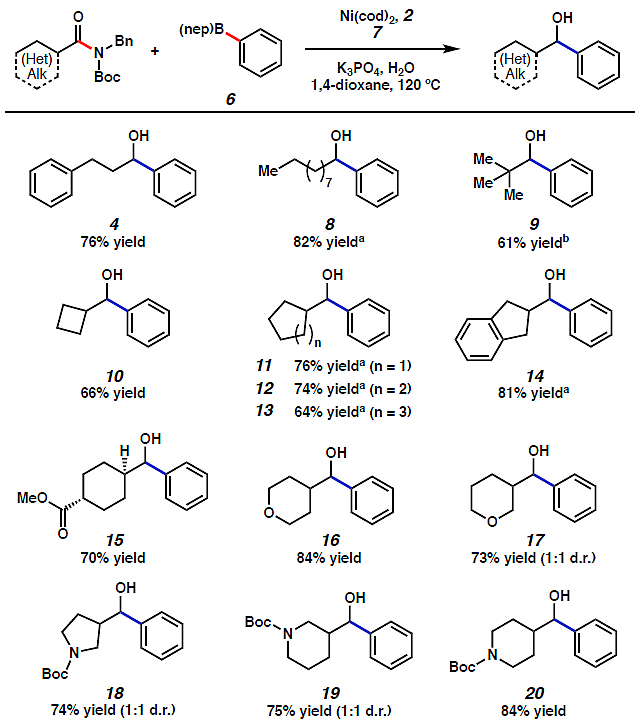
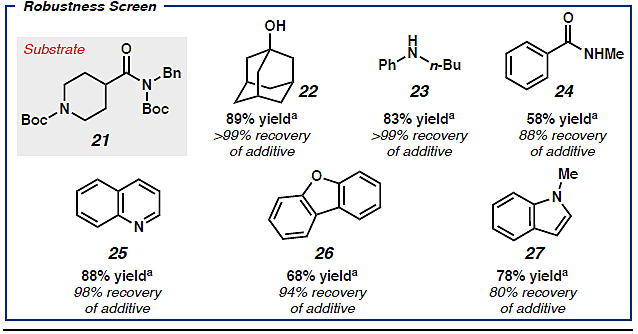
图4. 底物扩展之一。图片来源:Angew. Chem. Int. Ed.
接下来,作者考察了芳基硼酸酯的底物范围(图5)。无论芳基硼酸酯的邻位、间位还是对位上带有甲基取代基都能兼容该反应,以中等的收率(55-62%)得到醇28-30。三甲基硅烷基或三氟甲基取代的芳基硼酸酯以及萘基硼酸酯均能实现这一转化,以良好的收率(53-63%)得到醇31-33。作者还考察了几种带有不同取代基的硼酸酯,结果显示芳基酯、醚和二甲基胺都能耐受该反应,以良好的收率得到目标产物醇34-36。此外,吗啉取代的吡啶硼酸酯也能用于合成醇37,进一步显示了该反应对富含杂原子单元的耐受性。
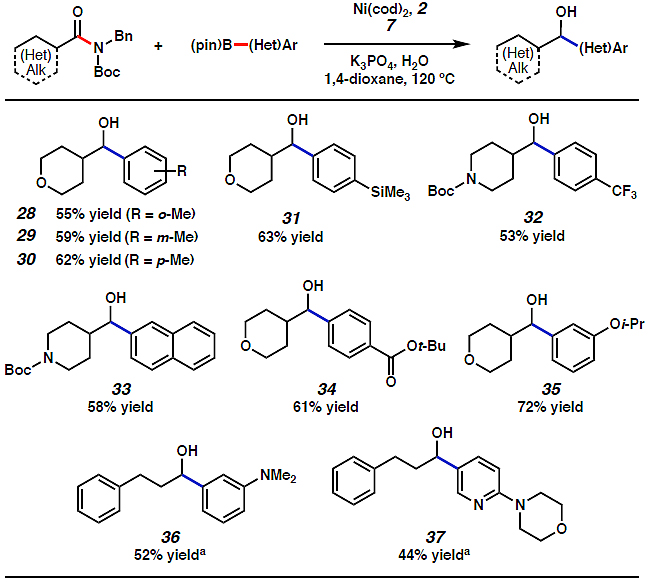
图5. 底物扩展之二。图片来源:Angew. Chem. Int. Ed.
最后,作者对该方法的实用性进行了评估(图6)。如图6a所示,酰胺38与硼酸酯39发生还原芳基化反应,得到的醇40是一种已知的γ-分泌酶调节剂41的前体。类似地,作者还以氟西汀为目标,将衍生自市售羧酸的酰胺42与硼酸酯6进行偶联反应,以69%的收率得到醇43,提供了一条从市售原料出发合成44的已知中间体的简便途径。这些结果不仅证明了利用交叉偶联方法将两个不同的亲核试剂加成到酰胺羰基碳上的可行性,还展示了该还原芳基化反应在复杂手性分子合成中的实际应用。
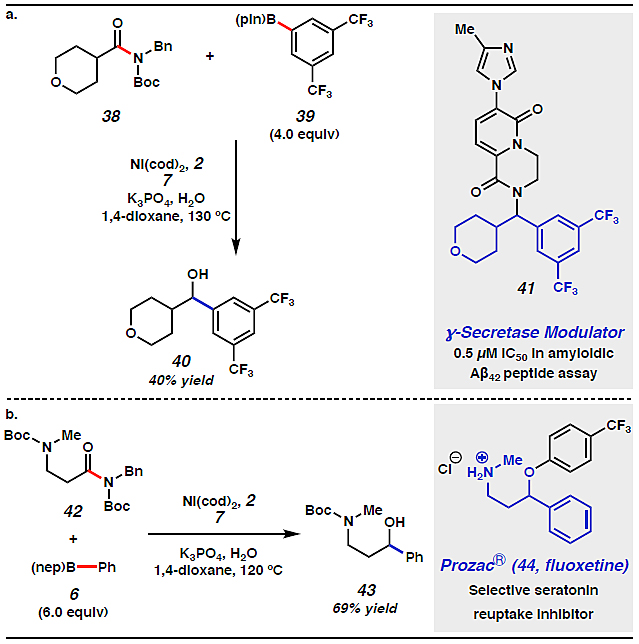
图6. 合成应用。图片来源:Angew. Chem. Int. Ed.
总结
Neil K. Garg教授课题组报道了一种将两种不同的亲核试剂直接加成到酰胺羰基碳上的新方法。这种转化通过非贵金属催化的Suzuki-Miyaura交叉偶联和随后转移氢化的串联反应,将酰胺轻松地转化为手性醇,并用于药物分子的合成。该反应不仅底物范围广,还能耐受醇、胺、酯、醚、仲酰胺、杂环化合物等官能团。相信不久的将来,这项研究将促进其它方法的发展,即通过催化串联过程将羧酸衍生物直接转化为带有手性中心的官能团。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Reductive Arylation of Amides via a Nickel-Catalyzed Suzuki–Miyaura Coupling and Transfer Hydrogenation Cascade
Timothy B. Boit, Milauni M. Mehta, Junyong Kim, Emma L. Baker, Neil K. Garg
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202012048
导师介绍
Neil K. Garg
https://www.x-mol.com/university/faculty/835
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号