Angew:瞬态亚胺的脱羧烷基化
近年来,C-H键活化得到了迅猛的发展,已广泛应用于天然产物、药物研发以及材料等领域。鉴于脂环族胺是生物活性材料和药物分子中一类基本的结构单元,因此不少化学家通过C-H键官能团化来合成取代的脂环族胺。然而,目前的研究大多数集中于3°胺或带有保护基的2°胺,从相应的母体胺直接进行α-官能团化来合成2°(即未保护的)脂环族胺的相关报道则较少(图1)。此外,在α-位带有取代基的2°脂环族胺上进行α'-C-H键官能团化是极具挑战性的,特别是α-位带有电子活化的取代基,这些取代基有利于在取代位点进行官能团化(即α-C-H键官能团化)。
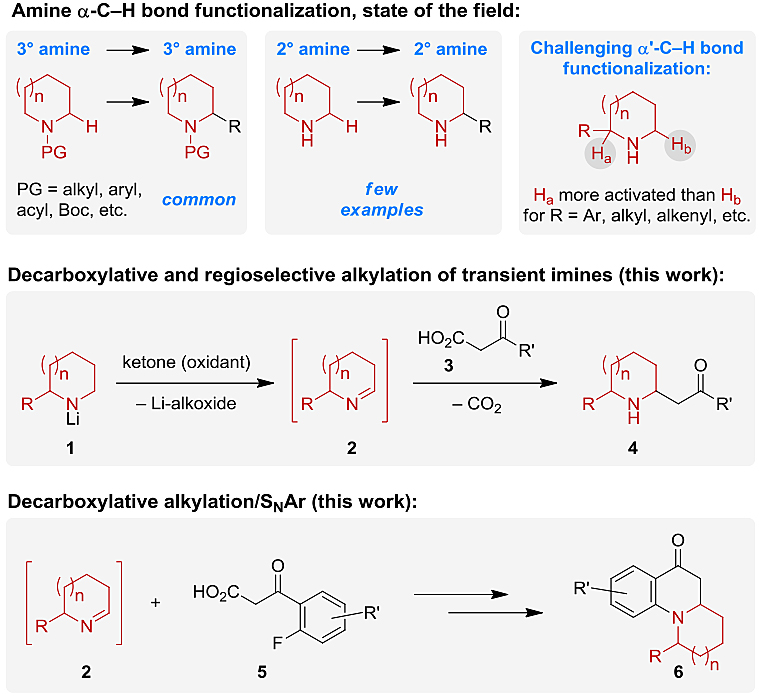
图1. 胺的C-H键功能化方法概述和当前策略。图片来源:Angew. Chem. Int. Ed.
在此前的工作中,美国佛罗里达大学化学系的Daniel Seidel教授(点击查看介绍)课题组报道了一种未保护脂环族胺C-H键官能团化的新方法(Nat. Chem., 2018, 10, 165, 点击阅读详细;J. Am. Chem. Soc., 2019, 141, 8778;Nat. Chem., 2020, 12, 545, 点击阅读详细)。具体而言,锂酰胺1在酮氧化剂作用下转化为瞬态环状亚胺2,后者与有机锂亲核试剂反应生成α-官能团化产物。该反应同时还实现了α-取代脂环族胺的区域选择性α'-C-H键官能化。此外,通过使用Lewis酸来活化亚胺中间体,亲核试剂的范围可以扩展到其他金属有机化合物(如格氏试剂)。然而,事实证明α-取代胺的α'-C-H键官能团化与Lewis酸活化无法兼容,从而限制了亲核试剂的范围。在此基础上,近日Daniel Seidel教授课题组通过β-酮酸3的脱羧烷基化,实现了瞬态亚胺2的快速多样化转化,从而制备了一系列β-氨基酮4。此外,利用邻氟芳基-β-酮酸5,还可以通过后续SNAr反应一锅法制备多环胺6。相关成果近期发表在Angew. Chem. Int. Ed. 上。
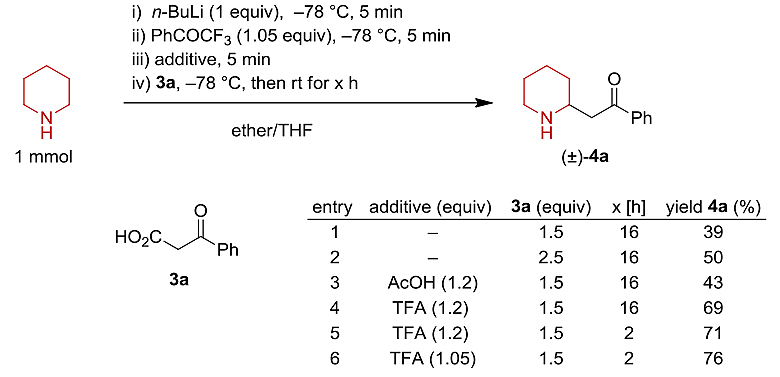
图2. 反应的发现。图片来源:Angew. Chem. Int. Ed.
亚胺与β-酮酸的Mannich反应及其脱羧反应是制备β-氨基酮的强有力工具。为了确定锂酰胺原位生成的脂环族亚胺是否与脱羧Mannich过程兼容,作者评估了一系列反应条件。如图2所示,他们选择哌啶和β-酮酸3a作为模板底物,在胺去质子化后用三氟苯乙酮处理以快速获得1-哌啶亚胺,接着加入β-酮酸3a(1.5当量)并在室温下搅拌,以39%的产率获得了所需的目标产物β-氨基酮4a。通过增加3a的当量(1.5当量→2.5当量),可将4a的产率提高到50%。考虑到由三氟苯乙酮还原产生的Li-醇盐可能会干扰随后的脱羧烷基化反应,为此作者添加了酸性添加剂。事实上,添加酸性添加剂均观察到产率或多或少的提高。其中三氟乙酸(TFA)作为添加剂的效果要明显优于乙酸,可能是因为乙酸锂具有足够的碱性来阻止加成过程的进行。经过一系列条件优化,最终以76%的收率获得产物4a(entry 6)。
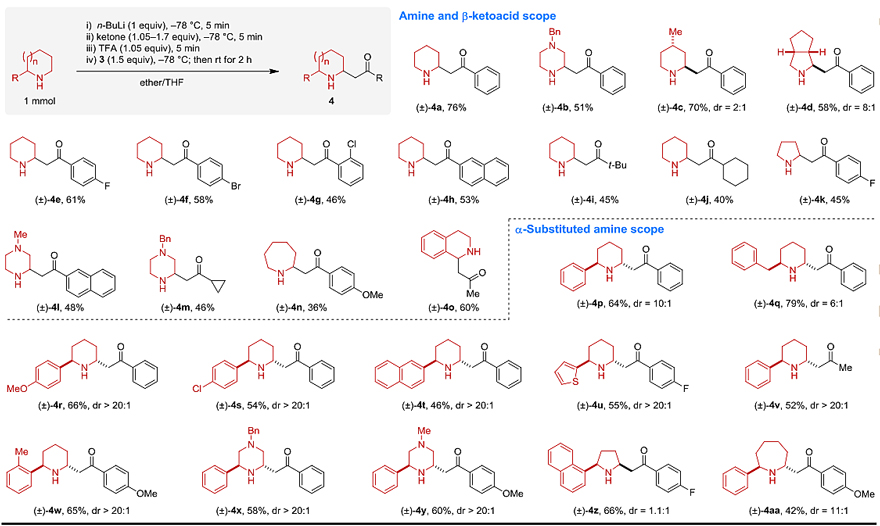
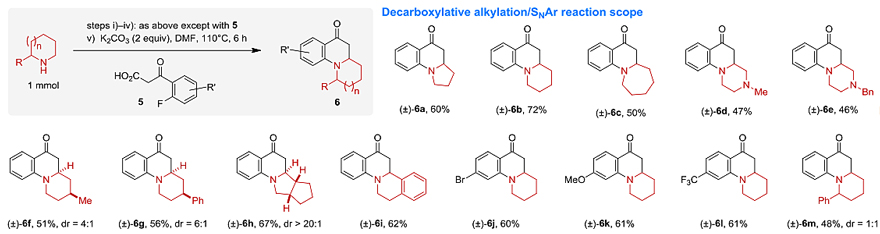
图3. 底物扩展。图片来源:Angew. Chem. Int. Ed.
在最优条件下,作者考察了脂环族胺和β-酮酸的底物范围(图3)。对于β-酮酸而言,无论芳基酮上带有供电子取代基还是吸电子取代基都能兼容该反应,以良好的收率得到目标产物(4a-4h、4k-4l、4n);甚至烷基酮(4i-4j、4m、4o)也能耐受该反应。对于脂环族胺而言,不同环大小的脂环族胺(如五元环胺4k、七元环胺4n)都能实现这一转化,甚至双氮杂环(4l、4m)也能耐受该反应,以良好的收率得到β-氨基酮。值得一提的是,含α-取代基的胺均在α'-位进行反应,以中等至较好的收率(42-79%)和非对映选择性(dr = 1.1:1~ >20:1)得到所需的产物,进一步证实了该反应具有优异的区域选择性。当使用邻氟芳基-β-酮酸5并通过后续的SNAr步骤便可一锅法制备各种多环二氢喹诺酮类化合物6,且无需分离中间体,而先前的方法却难以从未官能团化的胺出发直接合成多环二氢喹诺酮类化合物。

图4. 顺式产物的形成。图片来源:Angew. Chem. Int. Ed.
如图3所示,产物4p-4y主要以trans-非对映异构体的形式获得。实际上,trans-非对映异构体是这些反应的动力学产物,因为相应的cis-异构体已被证明在热力学上更稳定。这可能是非对映异构体相互转化的结果,或许是通过逆Mannich反应或逆共轭加成途径进行的。事实上,仅仅改变产物4p合成中的反应条件就可以完全逆转非对映选择性,有利于cis-异构体(图4)。
总结
Daniel Seidel教授课题组通过区域选择性的C-H键官能团化的脱羧Mannich过程实现了未保护脂环族胺的α-烷基化,对于α-位带有取代基的胺均选择性地在α'-位进行反应。在整个反应过程中仅需增加一个SNAr步骤,便可一锅法制备一系列多环二氢喹诺酮类化合物。相信不久的将来,该反应在有机合成和药物合成中具有重要的应用价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Diversification of unprotected alicyclic amines via C–H bond functionalization: Decarboxylative alkylation of transient imines
Anirudra Paul, Jae Hyun Kim, Scott D. Daniel, Daniel Seidel
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202011641
导师介绍
Daniel Seidel
https://www.x-mol.com/university/faculty/3074
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号