提升天然产物产量和活性的“最简单”方法——光照?
在天然药物研发过程中,产量和活性无疑是自始至终的两大核心目标。天然药化的同学们估计都有这样的体会——产量和活性就像孟老夫子所说的“鱼与熊掌”,几乎不可得兼。有些化合物活性虽好,但是分着分着就没了;而有些化合物产量倒是大,可是活性又筛不出来,号称“干啥啥不行,产量第一名”。大部分情况下,产量和活性问题都要分开来想办法解决。化学全合成,培养基的营养成分调控,以及环境因素研究,常用来提高产量,而基于构效关系分析来优化结构,则是提升活性的常见手段。那么,有没有简单的方法同时提升二者,兼得“鱼与熊掌”呢?
众所周知,光照是调节真菌生长、发育、繁殖和次级代谢产物生成的重要因素。近来,美国北卡罗来纳大学格林斯伯勒分校的Nicholas H. Oberlies教授(点击查看介绍)课题组发现,简单的光照即可促进真菌来源苝醌类天然产物hypocrellins和hypomycins的产量和抗癌活性(图1)。对于人皮肤黑色素瘤细胞,hypocrellins在纳摩尔水平上表现出很强的光致细胞毒性(photocytotoxicity)活性,而hypomycins则在微摩尔水平上,有望用于肿瘤的光动力学疗法(photodynamic therapy,PDT)。相关成果发表在J. Nat. Prod. 期刊上。
图1. 光照促进真菌来源苝醌产量和抗癌活性的提高。图片来源:J. Nat. Prod.
苝醌类天然产物hypocrellins(译作“竹红菌素”)具有一个氧化的五环核心和高度共轭的环体系,并表现出多种药理活性。引人关注的是,这类化合物独特的结构使其具有光动力疗法候选药物的潜力。目前,hypocrellins家族主要包括:hypocrellin (1)、hypocrellin A (2)、hypocrellin B (3)、shiraiachrome A (4) 以及本文分离到的ent-shiraiachrome A (5)(图2)。然而,研究这类化合物遇到的第一个难题就是产量低,这是因为该类化合物具有轴手性、阻转异构以及互变异构,使其化学全合成困难重重(如合成化合物2需要19步反应,但总产率仅有1.6%)。因此,通过发酵培养能产生竹红菌素的菌株,调节培养基有效成分、生长条件和环境因子来提高产量或许是一个不错的选择。
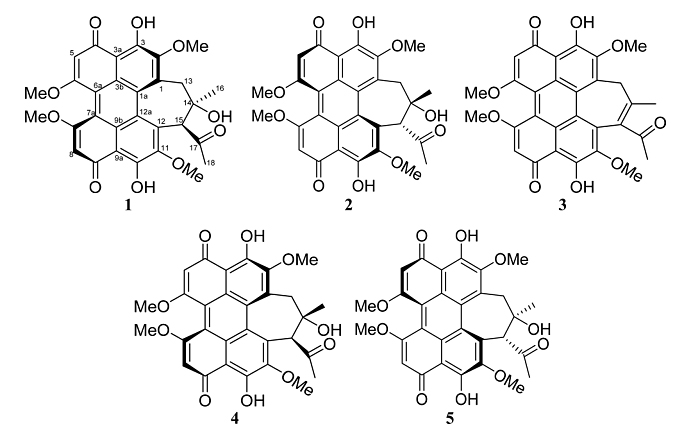
图2. hypocrellins家族化合物1-5的结构。图片来源:J. Nat. Prod.
在这些影响因素中,作者尤其对光照作用感兴趣,因为以往的研究表明光照会影响竹红菌素的产生(Photochem. Photobiol., 2019, 95, 812-822),尽管这种影响还存在不确定性。为研究竹红菌素产量和活性的影响因素,他们选择一株生产竹红菌素的真菌(菌株号MSX60519)作为研究对象,分别通过大米、麦片(Cheerios)和燕麦固体培养基进行发酵,并在发酵过程中分别设置三种光照条件(12 h : 12 h光照-黑暗交替、连续LED灯照射、连续黑暗)。待发酵结束后,收集菌株培养提取物,并用超高效液相色谱-高分辨质谱联用技术(UPLC-HRMS)来确认ent-shiraiachrome A(5)和hypocrellin(1)的生成,同时测定它们的相对丰度。结果表明,在连续黑暗的条件下,菌株产生的化合物1和5丰度最低,而12 h : 12 h光照-黑暗交替和连续LED灯照射都能显著地提高化合物1和5的丰度,这进一步证实光促进了这些化合物的生物合成。在三种培养基中,光照下大米固体培养基发酵产生的化合物1和5丰度最高(图3),其中化合物1的分离量为8-10 mg,而化合物5的分离量则高达~100 mg。

图3. 菌株MSX60519产生的化合物1和5在三种培养基和外在条件下的丰度。图片来源:J. Nat. Prod.
随后,他们对化合物5、1和3进行结构解析。通过高分辨质谱(HRESIMS)、二维核磁图谱(2D NMR)和电子圆二色谱(ECD)分析,得出化合物1(hypocrellin)是化合物2(hypocrellin A)的对映异构体,化合物5是shiraiachrome A (4)的对映异构体,并将其命名为ent-shiraiachrome A(5)。这类化合物因其特殊的结构存在阻转异构(atropisomerization)和烯醇-酮互变异构(tautomerism,图4)。其中化合物1和2在室温下以4:1的阻转异构体混合物形式存在;而化合物5和4则以相对较慢的方式形成阻转异构体平衡混合物。另一方面,包括5在内的hypocrellins化合物在室温下都以1:1的烯醇-酮互变异构体混合物形式存在。有趣的是,化合物3的ECD图谱只有基线,这表明化合物3是以外消旋混合物形式存在的。
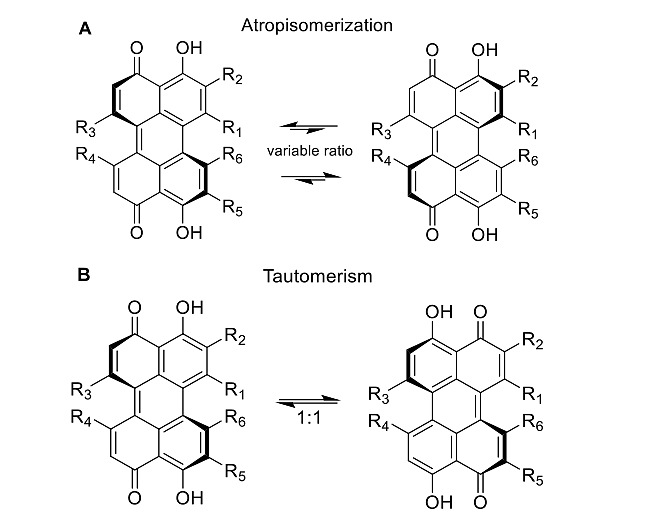
图4. hypocrellins的阻转异构和烯醇-酮互变异构。图片来源:J. Nat. Prod.
接下来,他们进一步解析分离到的化合物6、7、8。同样地,通过HRESIMS、2D NMR、ECD、NOESY以及红外圆二色谱解析,分别将3个化合物鉴定为hypomycin A (6)、 hypomycin C (7)、hypomycin E (8)(图5),并确定了它们的绝对构型。有趣的是,对于这些hypomycins来说,最合适的培养基并非此前提到的大米培养基,而是燕麦培养基。
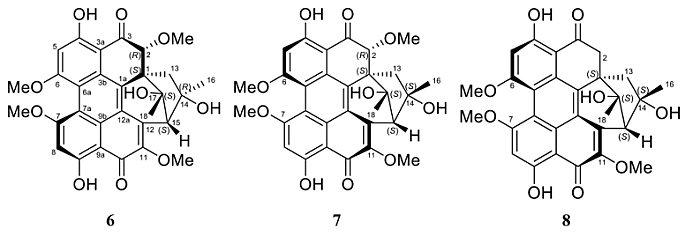
图5. 化合物6、7、8的化学结构。图片来源:J. Nat. Prod.
在此基础上,他们选择人皮肤黑色素瘤癌细胞系(SK-MEL-28)来评估化合物1、3、5和6-8的活性,进行光细胞毒性实验,先用浓度范围为1 nM—300 μM的化合物来处理黑色素瘤细胞,并在黑暗、宽带可见光(100 J/cm2)或单色红光(100 J/cm2,625 nM)的条件下于37 °C(5%CO2)培养16 h,通过EC50值和光疗指数(PIs)进行评估。结果显示,化合物1、3、5在黑暗状态下细胞毒性较弱(39.3-130 μM),而在可见光及红光照射下,细胞毒性极大提高(可见光10.3-53.5 nM;红光15.3-59.2 nM)。这表明化合物1、3、5很有希望用于肿瘤的光动力学疗法。相比之下,尽管化合物6-8则表现出相对较弱的光敏效应,但在可见光及红光照射下细胞毒性较黑暗状态仍有明显提高。而他们推测这可能是因为化合物6-8相比于1、3、5缺少Δ1(2)位双键,导致彼此光敏活性的差异。

图6. 化合物1、3、5和6-8对SK-MEL-28癌细胞的EC50值和光疗指数(PIs)。图片来源:J. Nat. Prod.
总结
本文研究了真菌固态发酵法生产苝醌类天然产物hypocrellins和hypomycins及其生物活性。不同培养基对产量有显著影响,最有趣的是,这些真菌代谢物的产量和生物活性都可以通过光照来提升。特别是生物活性方面,hypocrellins在可见光及红光照射下的细胞毒性可极大提高,达到纳摩尔水平,是一类很有前途的天然光敏剂,有望用于肿瘤的光动力学疗法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enhanced Production and Anticancer Properties of Photoactivated Perylenequinones
Zeinab Y. Al Subeh, Huzefa A. Raja, Susan Monro, Laura Flores-Bocanegra, Tamam El-Elimat, Cedric J. Pearce, Sherri A. McFarland, Nicholas H. Oberlies
J. Nat. Prod., 2020, 83, 2490–2500, DOI: 10.1021/acs.jnatprod.0c00492
导师介绍
Nicholas H. Oberlies
https://www.x-mol.com/university/faculty/58078
(本文由水村山郭供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!










































 京公网安备 11010802027423号
京公网安备 11010802027423号