稀土催化喹啉化合物的区域多样性C-H烷基化
喹啉是一类常见的含氮杂环,广泛存在于各种药物分子以及天然产物中。发展喹啉化合物的高效区域多样性碳氢键官能化将有效促进喹啉及其衍生物的快速合成,从而为药物筛选提供可靠手段。理论上来说,以相同的喹啉与烯烃为起始原料实现其区域多样性的碳氢键烷基化反应是高效构建各种烷基取代喹啉的一条理想途径。尽管如此,目前仍没有合适的催化体系能实现这样的转化。
从已有的报道来看,喹啉化合物与烯烃的碳氢键烷基化反应主要集中在铑、镍等过渡金属催化喹啉含氮杂环部分的选择性烷基化反应,实现反应活性相对较低的喹啉碳环(如喹啉C8位)的选择性烷基化反应仍然非常具有挑战性(图1a)。比如,要实现喹啉C8位与烯烃的烷基化反应需要将喹啉底物氧化成相应的N-氧化物,利用氧原子作为环外导向基团,这样不仅增加反应步骤,且仅适用于C2位无取代基的喹啉化合物(图1b)。而值得注意的是,中性喹啉(尤其是C2取代喹啉)的直接C8位碳氢键与烯烃的烷基化反应仍未被实现。
日本理化学研究所(RIKEN)的侯召民(Zhaomin Hou)教授(点击查看介绍)课题组长期致力于半夹心型稀土金属烷基化合物的合成及其在烯烃聚合与C−H键活化反应的研究。该类型催化剂在反应选择性等方面往往表现出异于后过渡金属催化的一些特性(Acc. Chem. Res., 2015, 48, 2209−2220)。同时,半夹心型稀土金属烷基络合物的多样性也为催化剂的开发与设计及其在反应立体控制等方面的优异表现提供了可能(J. Am. Chem. Soc., 2020, 142, 5531-5537)。最近,该研究团队通过对半夹心型稀土催化剂的空间位阻调控(稀土金属和环戊二烯配体组合的调控),实现了首例喹啉化合物与烯烃的区域多样性烷基化反应。其中包括,首次实现了中性喹啉的C8位与烯烃的烷基化反应。而对于C2位芳基取代的喹啉化合物,通过调控配体与金属的组合实现了同一组反应底物不同区域选择性的碳氢键烷基化反应。通过与安徽大学罗根教授合作进行的大量DFT计算结果揭示了不同稀土催化剂在反应选择性控制方面的内在原因。
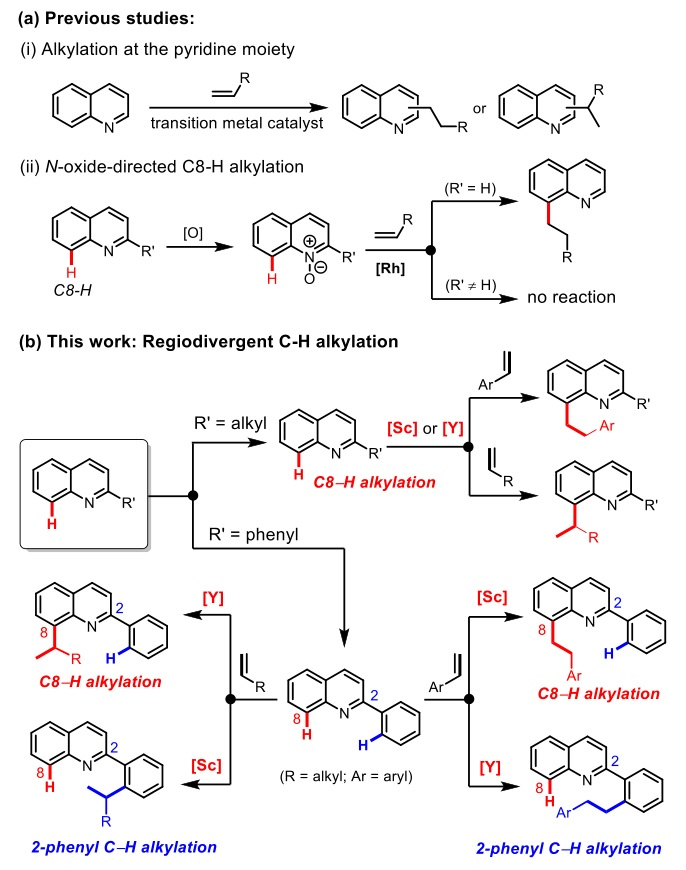
图1. 喹啉化合物与烯烃的区域选择性C-H烷基反应。图片来源:J. Am. Chem. Soc.
通过筛选稀土催化剂,作者发现利用钪催化剂Sc-3(较大位阻配体与较小金属的组合)能高选择性地实现各种2-芳基喹啉与芳基烯烃的选择性C8-H烷基反应,从而表现出于与此前后过渡金属催化中不一样的反应区域选择性。有趣的是,利用同样的催化体系,2-芳基喹啉与烷基烯烃的反应中高选择性地发生在C2位芳环上(图3,上)。当使用拥有较小位阻配体的大半径稀土钇催化剂Y-2时,2-芳基喹啉与芳基烯烃的选择性烷基化反应主要发生在C2位芳环上。相反地,2-芳基喹啉与烷基烯烃的反应则高选择性地发生在喹啉C8位(图3,下)。
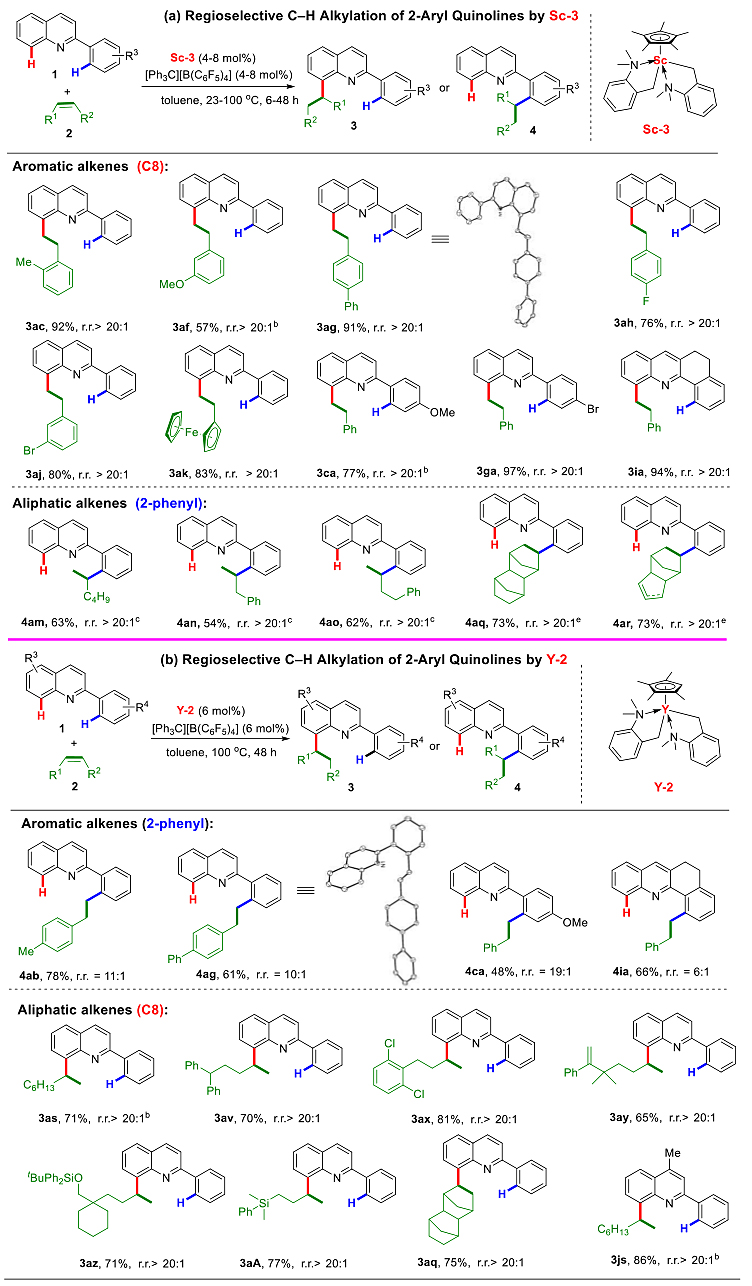
图2. 2-芳基喹啉与不同烯烃的区域各异C-H烷基化反应(部分底物)。
除了C2-芳基取代的喹啉化合物,作者还实现了其他取代喹啉与烯烃的选择性C8位碳氢键烷基化反应。从图3选取的部分产物可知,该稀土催化体系具有非常优秀的官能团兼容性。除了能够兼容烷氧基、卤素、硅基、不饱和碳碳键等基团,对路易斯酸敏感的官能团比如杂环、烷基胺、亚胺等在该体系中也具有很好的耐受性。此外,在后过渡金属催化中常常不兼容的硫醚以及含膦基团也不影响反应的进行(图3)。
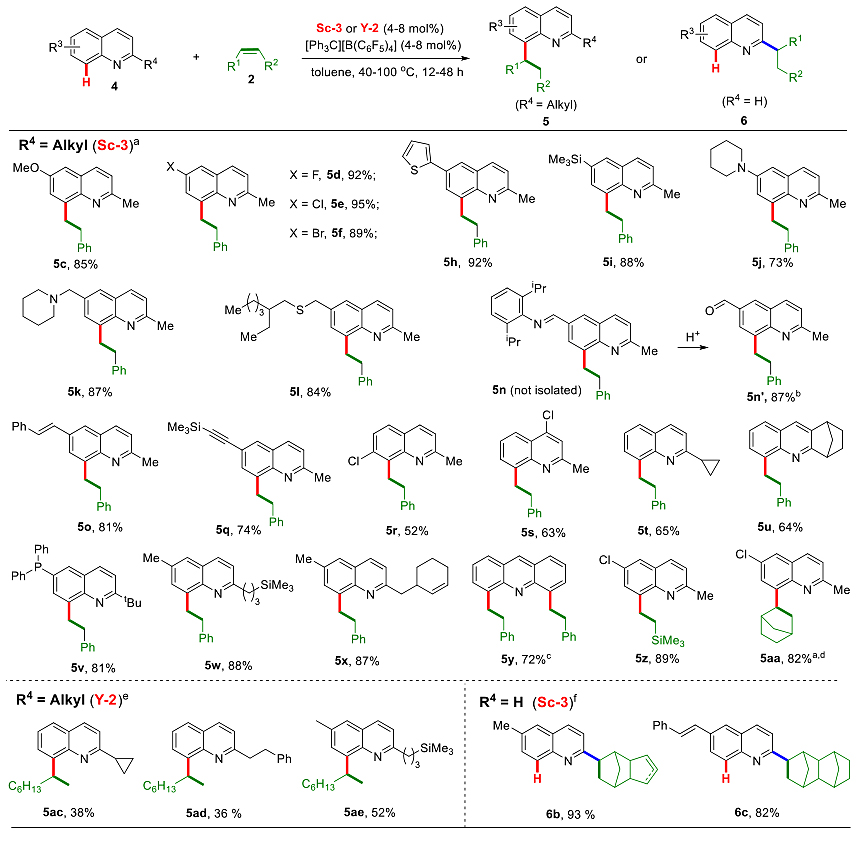
图3. 喹啉的C8-H烷基化反应(部分底物)。
为了进一步探究不同稀土催化剂在2-芳基喹啉与不同烯烃区域多样性反应中的作用机理,作者首先进行了一系列的氘代标记实验。在不加入烯烃的情况下,氘代的反应物1a-d5在Sc-3或者Y-2催化下,发生了2-芳基邻位氘原子往C8位迁移的现象。进一步的交叉实验表明,该H/D交换反应应该是通过两分子间的相互作用(图4)。
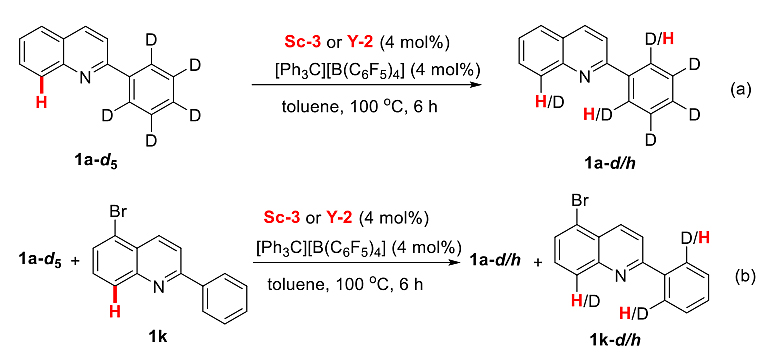
图4. 氘代标记实验。
在接下来的DFT计算中,作者首先考察了不同稀土催化剂在2-苯基喹啉最初碳氢键活化步骤中的选择性。对于拥有更大金属半径且更小配体的Y-2来说,底物与催化剂配体之间的位阻效应不明显,因此碳氢键活化反应优先发生在解离能较低的邻位碳氢键。而对于Sc-3来说,尽管2-苯基邻位碳氢键的解离能相对较低,但由于Sc-3较小的金属半径以及较大位阻的配体,导致其在2-苯基邻位碳氢键活化中产生了较显著的位阻效应,因此该催化剂更倾向于活化C8位碳氢键。值得注意的是,计算结果表明,尽管两个不同的催化在活化不同位置碳氢键时具有一定的区域选择性,但形成的两个不同环金属中间体可以在一定条件下相互转化,这不仅与氘代标记实验相符,同时也是实现区域多样性烷基化反应的前提条件(图5)。
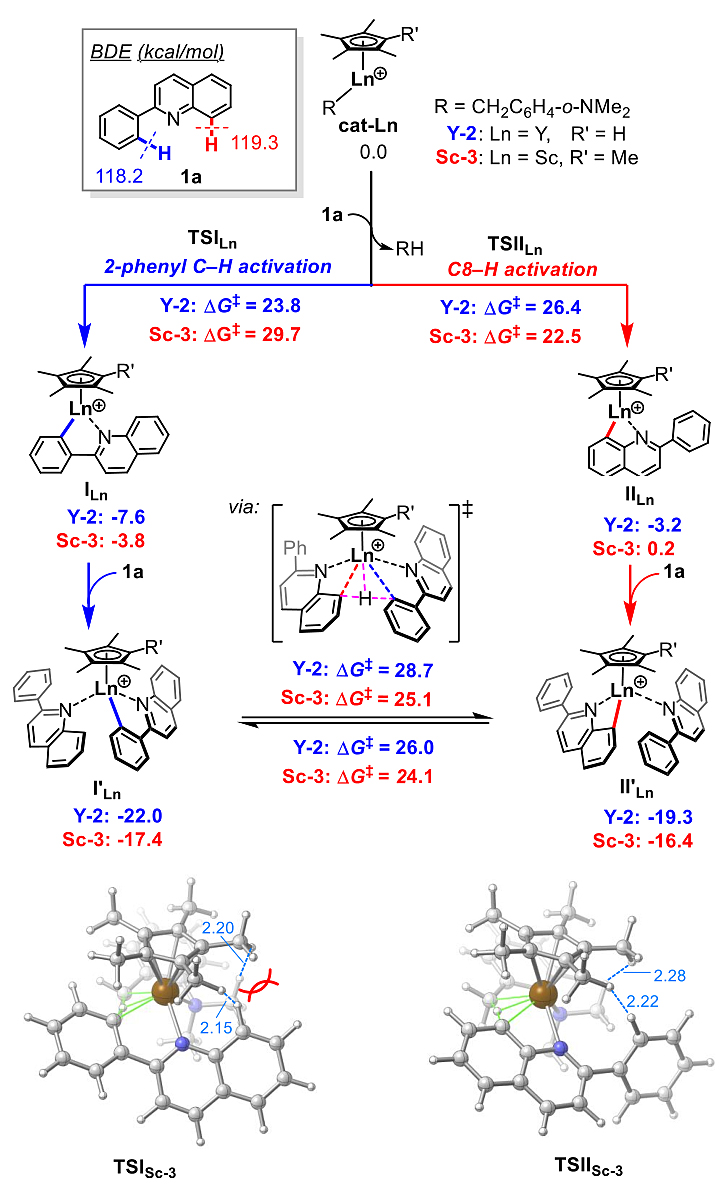
图5. 不同催化剂在区域选择性碳氢键活化中的作用机制。图片来源:J. Am. Chem. Soc.
随后,作者通过大量的DFT计算对后续的区域多样性烷基化反应作用机理进行了深入的分析。作者发现,在1a与苯乙烯的烷基化反应中,由于苯乙烯中苯环与稀土金属的作用力使得环金属中间体对苯乙烯的插入反应变得相对容易,其反应能垒低于优势环金属中间体向非优势环金属中间体转化所需的能垒,因此其反应的区域选择性与最初稀土催化剂控制的碳氢键活化区域选择性保持一致(图6a)。
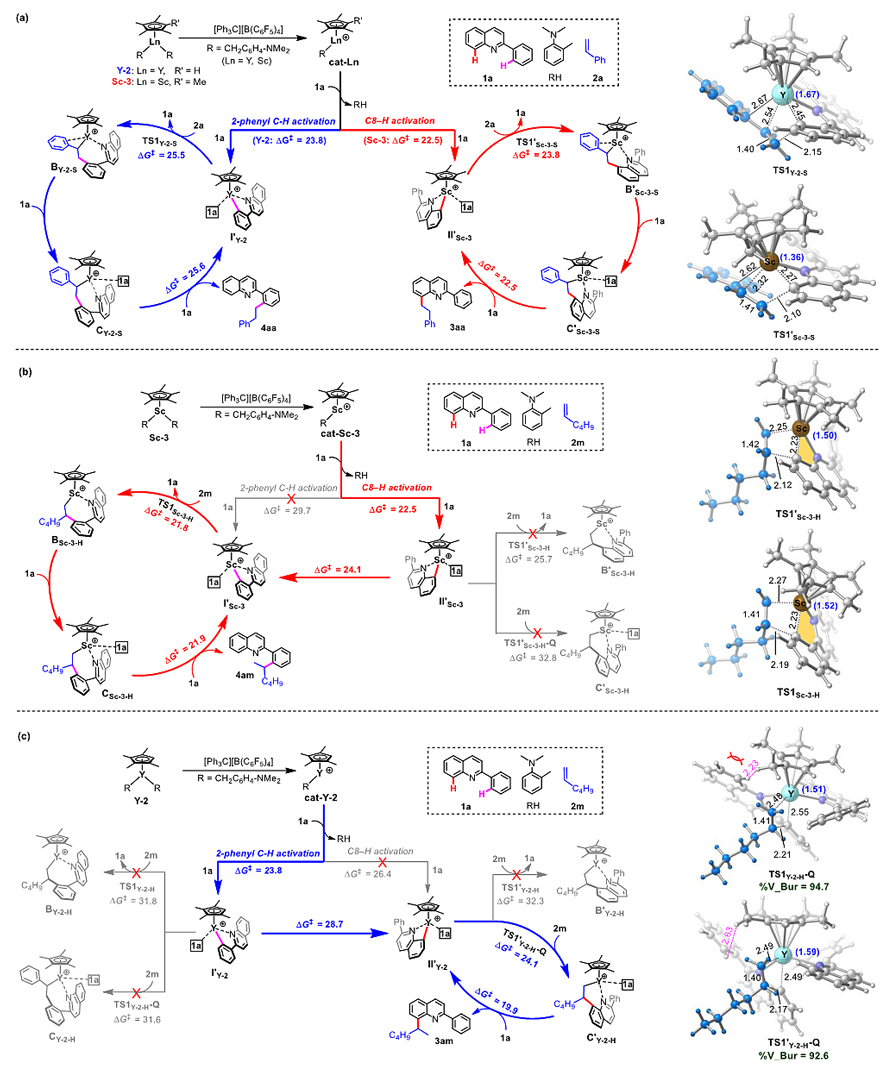
图6. 不同反应路径的DFT计算。图片来源:J. Am. Chem. Soc.
而1a与1-己烯的烷基化反应则相对来说复杂很多。由于缺少苯环-金属作用力,环金属物种对1-己烯的插入反应相对困难一些。因此,在Sc-3催化体系中,尽管初步碳氢键活化优先生成中间体II'Sc-3,但在随后的插入步骤中所需的反应能垒(25.7 kcal/mol)高于其转化为非优势中间体I'Sc-3的能垒(24.1 kcal/mol),而生成的I'Sc-3能顺利地进行后续的烯烃插入以及重新碳氢活化步骤,从而选择性地得到邻位碳氢键烷基化产物(图6b)。
同样的,在Y-2催化体系中,初步碳氢活化形成的优势环金属中间体I'Y-2与1-己烯的插入步骤所需的能垒(>31 kcal/mol)高于其向环金属中间体II'Y-2转化的反应能垒(28.7 kcal/mol),因此II'Y-2成为反应的活性物种。值得注意的是,不同于之前的催化过程,由于II'Y-2拥有更大的金属中心半径,在与1-己烯配位加成步骤中不需要解离其中一个底物分子,而这个底物分子的额外配位还能显著降低金属中心的电荷,从而降低后续步骤的能垒,这一独特的作用机制也获得了动力学控制实验的相应佐证(图6c)。总的来说,作者通过DFT计算发现喹啉与烯烃的碳氢烷基化选择性不仅取决于最初的选择性碳氢键活化,同时与不同环金属中间体间相互转化的难易以及与烯烃插入反应的难易密不可分。而区域多样性烷基化反应的实现得益于稀土半夹心型稀土金属烷基络合物的多样性(金属原子半径与配体调控),这不仅能加深对稀土催化体系在碳氢键官能化反应中作用机制的认识,同时也能启发后续新催化体系的发展。
总结
侯召民教授课题组最近发展了半夹心型稀土金属催化的喹啉化合物与烯烃的区域多样性选择性C-H烷基化反应。该催化策略具有选择性高、底物适用范围广等优点,为高效多样性地合成取代喹啉化合物提供了有力的手段。同时,通过DFT理论计算详尽展示了稀土催化剂在喹啉化合物碳氢键转化中的作用机制,为后续催化剂的设计及应用提供启示和理论支持。相关研究发表在Journal of the American Chemical Society 上,日本理化学研究所侯召民主任研究员和安徽大学罗根教授为该论文通讯作者,论文的第一作者为娄绍杰博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Regiodivergent C-H Alkylation of Quinolines with Alkenes by Half-Sandwich Rare-Earth Catalysts
Shao-Jie Lou, Liang Zhang, Yong Luo, Masayoshi Nishiura, Gen Luo,* Yi Luo, Zhaomin Hou*
J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c08362
导师介绍
侯召民
https://www.x-mol.com/university/faculty/31089
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号