华侨大学程国林课题组:O-C(sp3)–C(sp2)官能团选择性插入羰基C-C键
酮广泛存在于天然产品和合成分子中,在有机合成中是最基本的原料之一。虽然有很多反应涉及酮碳基的α位功能化和转化,但C(CO)-C单键的选择性断裂仍然是一个重大挑战。特别是,将官能团直接插入C(CO)-C单键,用以制备常规方法难以获得的化合物,具相当大的吸引力。例如,传统Baeyer-Villiger反应 (Chem. Rev., 2004, 104, 4105) 和Büchner-Curtius-Schlotterbeck反应(Chem. Rev., 2016, 116, 2937)可以将一个原子直接插入C(CO)-C键分别生成酯和同系酮(图1a)。最近,Dong(J. Am. Chem. Soc., 2019, 141, 16260),Murakami(J. Am. Chem. Soc., 2014, 136, 5912),Cramer(Angew. Chem. Int. Ed., 2014, 53, 9640),Martin(Angew. Chem. Int. Ed., 2015, 54, 9537),Chi(Nat. Commun., 2015, 6, 1),和Krische(J. Am. Chem. Soc., 2018, 140, 9091)等人广泛研究了过渡金属催化的不饱和单元(烯烃、丙二烯、炔烃、酮和亚胺)选择性插入到张力环C(CO)-C键的方法(图1b)。但是,将官能团插入到非张力C(CO)-C键是极为罕见的,其中一般需要导向基辅助。2018年,Bi报道了一例银催化非张力C(CO)-C键插入反应(Angew. Chem. Int. Ed., 2018, 57, 8927;iScience., 2018, 8, 54)(图1c)。可见,开发非张力C(CO)-C键多官能团插入方法,特别是衍生自不同分子的多官能团,在合成应用和机理研究中都具有重要意义。
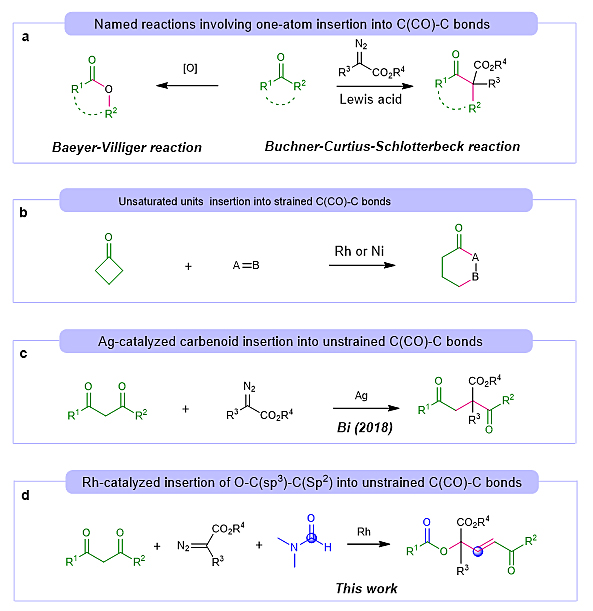
图1. 官能团插入C(CO)−C键
华侨大学材料科学与工程学院的程国林(点击查看介绍)课题组一直致力于过渡金属催化的碳碳键断裂反应研究(Chem. Sci., 2019, 10, 9104)。近期,该课题组发展了一种铑(II)催化的羰基碳碳键插入新策略。该策略可实现1,3-二酮,重氮酸酯和DMF多组分反应合成α,α,α-三取代酯(图1d)。控制实验和同位素标记实验表明,产物中所插入的官能团O、C(sp3)、C(sp2)分别来源于1,3-二酮,重氮酸酯和DMF。这一研究成果代表了一种全新的碳碳键断裂以及碳碳骨架重塑的“切割和缝合”方法。
作者在优化反应条件下,对1,3-二酮的底物范围进行探索。如图2所示,在其芳环上带有各种给电子或吸电子取代基(甲基、叔丁基、甲氧基、卤素和三氟甲基)的1,3-二酮均可在温和条件下转化为α,α,α-三取代酯(3b-p,产率为60-97%)。该反应的反应性受到芳基环上取代基电性的轻微影响。值得注意的是,芳基烷基1,3-二酮也以优异的产率和化学选择性生成了所需产物,而且C(CO)-C键的裂解反应选择性地发生在烷酰基碳键(3q-z和3aa-ae)。值得一提的是,该反应还适用于各种杂芳基取代的1,3-二酮(3ab-ad)。甚至,还可以将二茂铁单元高效地嵌入到产物中(3ae)。
随后,作者还研究了α-芳基重氮乙酸盐的底物范围(图2b)。首先着手研究取代基对α-苯基重氮乙酸酯的苯环的影响。底物苯环上取代基的电子性质的位阻对产率也有明显的影响,其中缺电子基团对该反应不利(4e-h)。作者评估了α-芳基重氮乙酸酯的酯部分,令人欣喜的是、乙基、异丙基、苄基、烯丙基、肉桂基、3-己烯基、炔丙基和2-溴乙基都具有良好的耐受性,以57-87%的收率获得了相应的产物(4a-v)。值得注意的是,作者还对α-苯基-N-甲基-N-苯基重氮乙酰酰胺的反应性进行了研究,以55%的收率制备了α,α,α-三取代酰胺(4w)。
尽管实验研究显示了广泛的底物范围,但这种转化也存在局限性。例如,当使乙酰丙酮、乙酰乙酸乙酯和N-甲基-3-氧代丁酰胺进行反应时,未观察到目标产物。另外α-烷基和α-H重氮酸酯不能提供相应的产物,这或许可以通过在铑(II)催化剂存在下卡宾前体的快速分解来解释。

图2. 底物拓展范围
该三组分反应同样适合于克级合成。在不改变标准条件的情况下以5 mmol的规模制备酯(3a),产率为78%(图3)。该反应产物的酯基和烯酮基提供了进一步转化的可能性。为了证明这一点,作者研究了3a的几种转化。首先,分别通过3a和3ae的水解/脱羧/异构化级联反应分别获得1,4-二酮产物(5a和5b),它们的产率很高,可作为Paal-Knorr吡咯合成的前体。第二,用K2CO3/MeOH溶液处理3a可得到酯交换/加成产物(6)。此外,用NaBH4还原3a可以生成醇(7)。
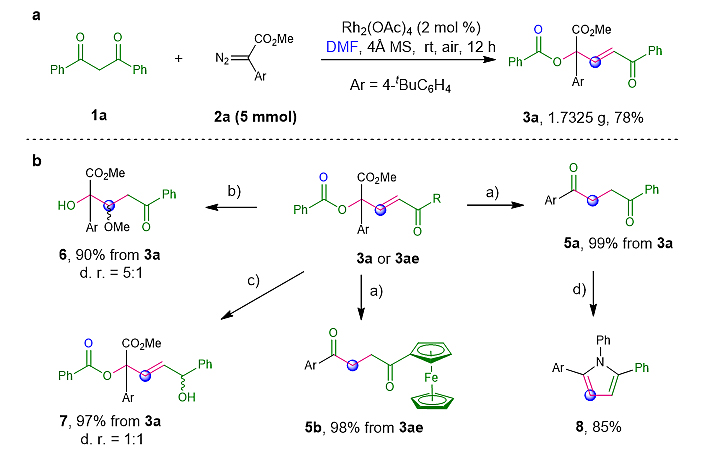
图3 克级反应和官能团转化
为了深入了解这种Rh催化的C(CO)-C键插入反应,作者对反应的机理进行深入探究。当加入2,2,6,6-四甲基-1-哌啶基氧基(TEMPO)或1,1-二苯乙烯(DPE)不会抑制反应,这表明自由基途径不太可能在该反应体系中涉及(图4a)。而不对称1,3-二酮(1af)和2a反应的结果表明,化学选择性受芳基电子密度的影响很小(图4b)。然后,在N,N-二乙基甲酰胺中进行1a和2a的反应,以37%的收率得到3a,而使用N,N-二甲基乙酰胺作为溶剂未形成任何产物。当使用N-甲基-N-苯基甲酰胺作为溶剂时,可以分别以21%和15%的收率分离出3a和N-甲基苯胺(图4c)。重要的是,与DMF-甲酰基-13C作为溶剂的反应以86%的收率得到3a-13C(图4d)。与DMF-二甲基-13C2的反应结果表明,碳源几乎不能源自DMF的N-甲基(图4e)。此外,作者使用DMF-D7进行了氘标记实验(图4f)。在酯产物(3a-D-1)的β位置观察到氘完全嵌入。这些结果表明,DMF的甲酰基是“一碳”源。接下来,当反应在5当量的D2O存在下进行时,观察到氘在产物(3a-D-2)的γ位置上的嵌入(图4g)。此外,使用3q-18O-1为底物,未检测到18O标记的酯交换/加成产物(6)(图4h)。这些反应表明在反应过程中可能产生水,并且3a的苯甲酰氧原子源自于原位生成的水。最后,当18O标记的1,3-二酮(1q-18O)进行反应时,可表明3q的α位置的氧原子源自1,3-二酮(图4i)。

图4. 控制实验和同位素标记反应
在对照实验和文献报道的基础上,作者提出了可能的反应机理(图5)。最初,α-芳基重氮乙酸酯(2)与Rh(II)催化剂反应生成Rh(II)卡宾配合物(A),该配合物被烯醇(B)捕获,得到叶立德氧鎓(C)。然后,C亲核进攻DMF得到醛中间体(D),随后进行D的分子内缩合反应,得到二氢呋喃中间体(E)。最后,中间体E可以通过逆Baylis-Hillman型反应转化为α,α,α-三取代酯(3和4)。
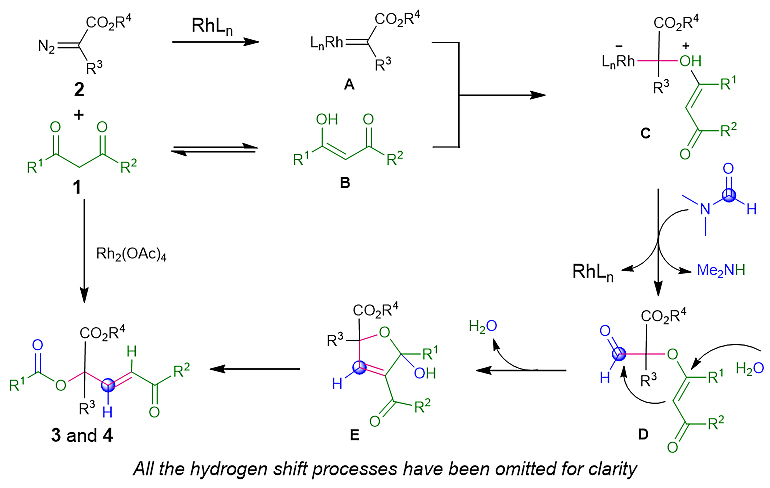
图5. 可能的反应机理。
综上所述,作者发展了一个Rh(II)催化的O–C(sp3)–C(sp2)直接插入C(CO)–C键的反应。该转化可在温和反应条件下进行,获得结构多样的α,α,α-三取代的酯/酰胺。目前作者实验室正致力该反应的不对称版本研究。
上述研究工作论文第一作者为2018级博士生巴聃。文思、田青于、陈燕惠、吕微微参与了本项工作并对本项工作作出了重要贡献。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Rhodium(II)-catalyzed multicomponent assembly of α,α,α-trisubstituted esters via formal insertion of O–C(sp3)–C(sp2) into C–C bonds
Dan Ba, Si Wen, Qingyu Tian, Yanhui Chen, Weiwei Lv, Guolin Cheng*
Nat Commun., 2020, 11, 4219, DOI: 10.1038/s41467-020-17990-z
导师介绍
程国林
https://www.x-mol.com/groups/glcheng
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号