Nat. Chem.:钌催化的多组分反应合成1,3-二烯-6-氧代聚酮
聚酮(Polyketides)是一类由细菌、真菌、植物与海洋动物所生产出来的具有重要生理活性的次生代谢产物(secondary metabolites),据统计约20%的畅销小分子药物都含有聚酮单元。尽管科学界和工业界对聚酮有着强烈的需求,但大多数聚酮天然产物的立体化学复杂性和富含sp3碳原子使其合成并不容易。一种常见的方法是仿生合成途径,即反复利用相同的单元反应(如烯丙基化、交叉偶联反应和羟醛缩合反应等)进行C-C键连接,制备诸如聚丙烯酸、聚烯和聚醇等高度重复的结构。显然,这种方法对制备含有不止一类C-C键的聚酮类化合物(如1,3-二烯-6-氧代聚酮)是无能为力的,但这类聚酮却数量众多(超过3000种,其中包括11种上市药物和11种临床候选药物)。而解决这个问题的传统方式是使用多步骤反应,这可能会涉及到预官能团化的试剂、繁琐的上/脱保护基、辅基引入、氧化还原反应,还会产生更多的废物。虽然早在1986年,Hoffmann等人就利用3-硼基-1,4-二烯与异丁醛的烯丙基化反应制备了1,3-二烯-6-氧代单元类似物1b(Chem. Ber., 1986, 119, 1039–1053),但反应的立体选择性很差(E:Z = 60:40),并且不对称的3-硼基-1,4-二烯发生烯丙基化反应时还会存在位点选择性的问题(CA vs CB,下图c)。
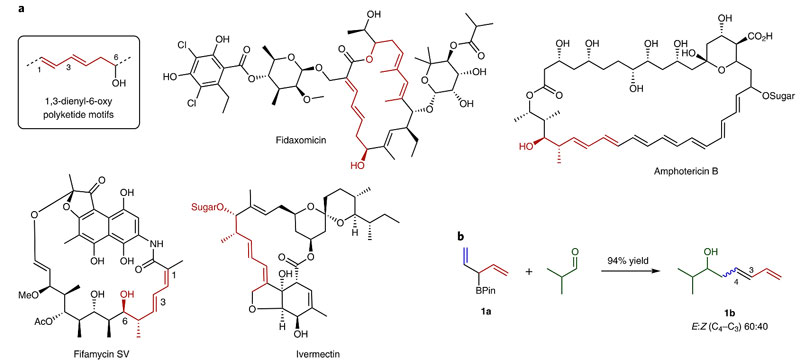
1,3-二烯-6-o氧代单元的天然产物及Hoffmann等人的工作。图片来源:Nat. Chem.
1993年,美国斯坦福大学的B. M. Trost教授课题组发现在钌催化剂的作用下,端烯能与炔烃发生偶联反应制备1,4-二烯(J. Am. Chem. Soc., 1993, 115, 4361–4362)。那能否将该反应推广到1,2-二取代的乙烯基硼酸酯呢?答案似乎是否定的,因为所需形成的钌杂环戊烯中间体位阻太大以及烯丙位不可控的β-H消除(J. Am. Chem. Soc., 2015, 137, 620–623)。但B. M. Trost课题组并没有被所谓的经验限制思路,他们认为硼取代的烯烃是可以避免上述问题的,因为体积较小的sp2杂化硼原子能降低钌杂环戊烯中间体Ru-I和β-H消除时的位阻效应(下图c),同时硼原子未填充的p轨道可以降低烯烃最低未占分子轨道(LUMO)的能量以稳定烯烃-Ru配合物的立体电子效应。最终,他们通过多组分反应的策略将原位生成的3-硼基-1,4-二烯(炔烃与乙烯基硼酸酯通过烯炔偶联反应制备)与醛发生选择性的烯丙基化反应,得到了不同取代的1,3-二烯-6-氧代结构单元,并简化了天然产物efomycine M的合成步骤。相关结果发表在Nature Chemistry 上。
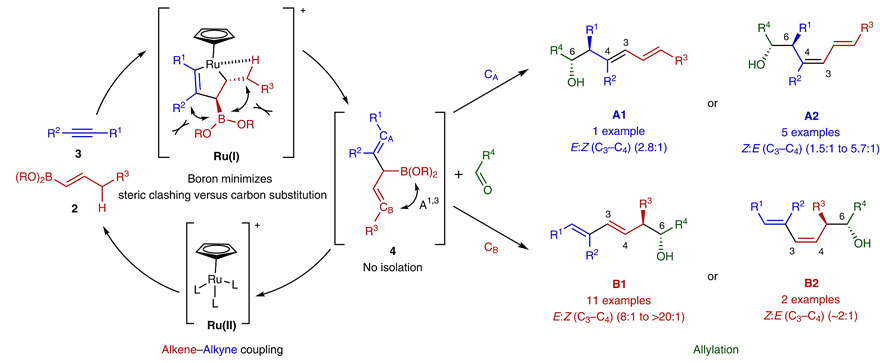
多组分反应设想。图片来源:Nat. Chem.
为了验证上述制备3-硼基-1,4-二烯的设想,研究人员通过自制或商品化的2-取代乙烯基硼酸(或硼酸酯)与炔烃进行反应。结果显示,在6-10%的CpRu(CH3CN)3PF6催化下,能以较好的分离收率得到3-硼基-1,4-二烯偶联产物4a和4b,而1,2-二取代的烯烃5(将BPin换成Me)却不能反应。此外,2e和2f的产物(7n和7o)对硅胶柱层析不稳定,因此通过NMR分析来监测反应。值得一提的是,当用丙酮作为溶剂时,还能以67%的收率分离到1,3-二烯-6-氧代单元化合物6c,这为后来多组分反应的开发提供了支持。
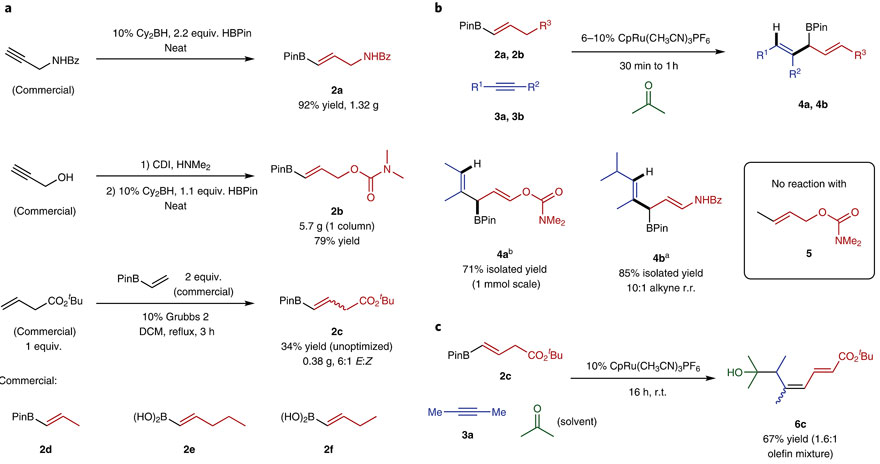
1,2-二取代的乙烯基硼酸与炔烃偶联。图片来源:Nat. Chem.
同样的,不同类型的炔烃也能兼容该反应,包括不对称1,2-二取代炔烃(如7f–7k)和附近含有杂原子的(如7l和7m)炔烃。端炔也能兼容该反应,并且反应的区域选择性取决于所用烯基硼酸酯的性质,例如:与烯丙基酰胺2a反应时主要生成直链状的二烯产物7p和7q;而与烯丙基氨基甲酸酯2b反应时则选择性地生成支链状的二烯产物8r。此外,位阻较小的炔烃(如7a、7d、7l、7m、7r)在与烯基硼酸反应后还能与溶剂氘代丙酮继续反应生成1,3-二烯-6-氧代单元化合物,而大位阻的炔烃(如7f–7k)则只能停留在3-硼基-1,4-二烯阶段。
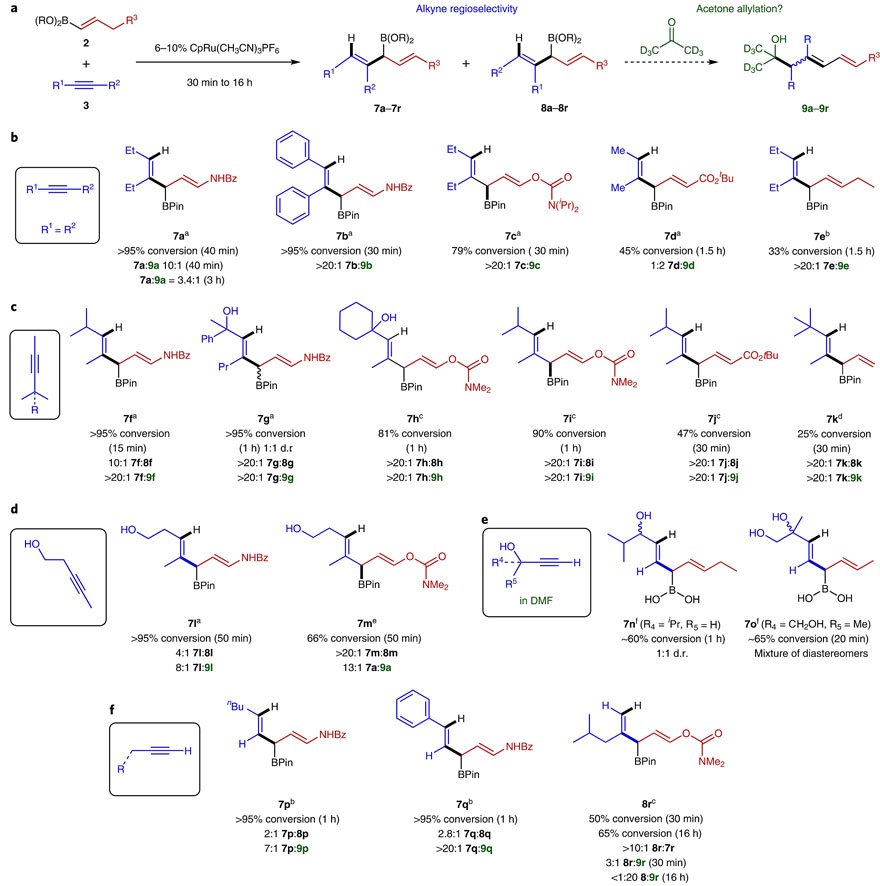
3-硼基-1,4-二烯的制备。图片来源:Nat. Chem.
接下来,研究人员开始考虑“一锅法”制备1,3-二烯-6-氧代单元化合物。主要有两种方式加入醛或酮:一是直接在反应前加入以消除丙酮的竞争性反应(如果有的话)(方法A);二是在烯炔反应后的溶液中加入以排除醛对Ru催化剂的抑制作用(如果有的话)并通过精确控温来保证不对称和非对映选择性的烯丙基化(方法B)。
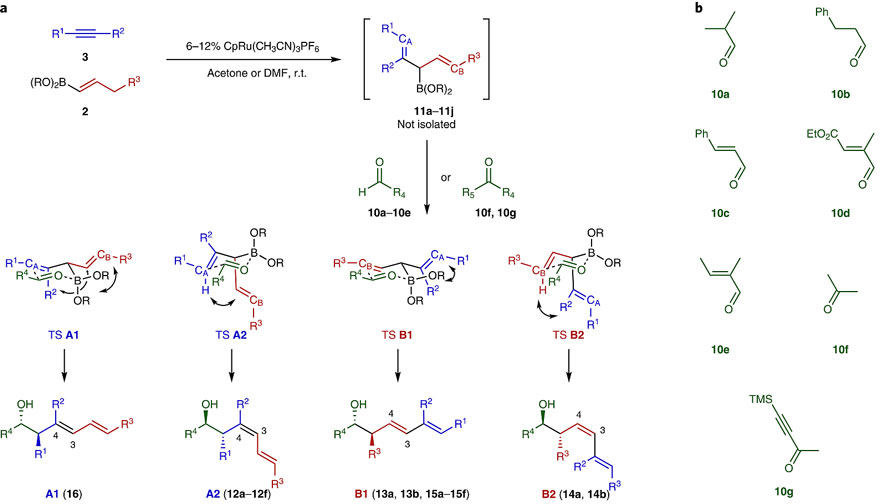
烯丙基化过渡态分析。图片来源:Nat. Chem.
那么区域选择性和C3=C4双键的立体化学是如何产生的呢?
如上图所示,3-硼基-1,4-二烯与醛的烯丙基化会产生四种Zimmerman–Traxler过渡态,分别是从CA端反应的TS A1和TS A2以及从CB端反应的TS B1和TS B2,其中A1和B1产生E-式构型的C3=C4双键,而A2和B2产生Z-式构型的C3=C4双键。至于从哪一端进行反应则取决于立体效应和电子效应。一般来说,烯丙基化的反应位点远离含有大位阻(下图b-d)基团、供电子和吸电子基团(下图a),例如10d(R1和R3都是导向基团)的烯丙基化反应优先发生在CB位(11g)。
至于新产生的C3=C4双键的立体化学,研究人员认为主要取决于硼原子上的取代基(频哪醇硼酸酯vs硼酸)和二烯试剂上的取代基R2。频哪醇硼酸酯(BPin)主要倾向于Z-式构型的C3=C4双键,而硼酸则优选E-式构型的C3=C4双键(下图c vs d)。这是由于过渡态TS B1中硼酸上羟基与处于平伏键上的α-乙烯基取代基存在最小的gauche位阻效应,因此TS B1是优势构象,导致产生E-式构型的C3=C4双键,而空间位阻较大的BPin的gauche效应变得很大,有利于通过TS B2构象得到Z-式构型的C3=C4双键。对于R2取代基的影响就非常微妙了,因为它高度依赖于烯丙基化的反应位点(CAvs CB)。当在CA处进行反应且R2为烷基时,此时TS A1中烯基的R2取代基与平伏键α-烯基片段存在较大的烯丙基张力,导致通过TS A2进行反应得到Z-式构型的C3=C4双键。而当在CB处进行反应且R2为甲基时,TS B2中烯基的R2取代基与CB上直立键C-H键存在较大的烯丙基张力,导致优先通过TS B1进行反应得到E-式构型的C3=C4双键。但当在CB处进行反应且R2为氢时,上述TS B2中的烯丙基张力得到缓解,因此虽然以TS B1为主,但选择性明显降低(下图c)。值得一提的是,这些3-硼基-1,4-二烯试剂还能与不对称酮发生烯丙基化反应生成叔醇(如12f和15f)。另外,尽管TS A1是不利的过渡态,但通过TS A2制备的12a可以用热力学方法转化为形式上的TS A1产物16。
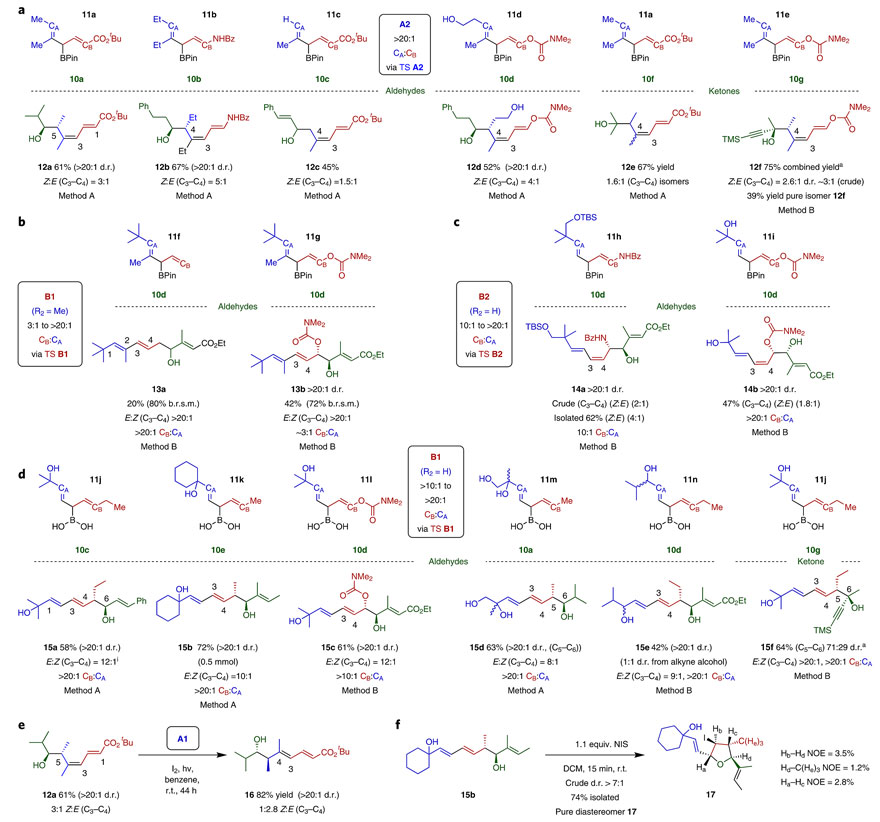
一锅法构筑1,3-二烯-6-o氧代单元化合物。图片来源:Nat. Chem.
接着,研究人员利用立体化学确定的丙炔醇19与烯基硼酸2e、异丁醛10a进行反应制备了多烯21。在这个过程中,丙炔醇19扮演了三种角色:第一,为烯炔偶联反应提供优异的区域选择性;第二,利用自身位阻效应控制烯丙基化的反应位点;第三,发生原位Peterson烯化完成双键的构筑。这样,仅需两步操作就能完成具有多个立体化学中心的聚酮类化合物vacidin A的多烯骨架合成。
此时,研究人员开始考虑能否通过手性醛对中间体3-硼基-1,4-二烯进行动力学拆分,进而合成立体化学确定的1,3-二烯-6-氧代结构单元。为了验证概念,他们以消旋的醛23a进行测试,结果显示在标准条件下,以非常好的收率和非对映选择性得到消旋的24a,这暗示该过程确实涉及Felkin–Anh模型控制的动力学拆分。因此,当他们用手性醛23b-23d和26进行反应时,毫无疑问地得到了手性产物24b-24d和28,d. r. 值高达> 20:1。即使在5 mmol规模下进行反应,也对产率和d. r. 值影响不大(如24c),并且不需要保护基,证实了该方法具有很好的原子经济性和步骤经济性。这一点也被后面(+)-efomycine M的全合成进一步体现,因为研究人员应用该方法将Barth和Mulzer等人原本22步的合成路线(Angew. Chem. Int. Ed., 2007, 46, 5791–5794)缩短到14步。
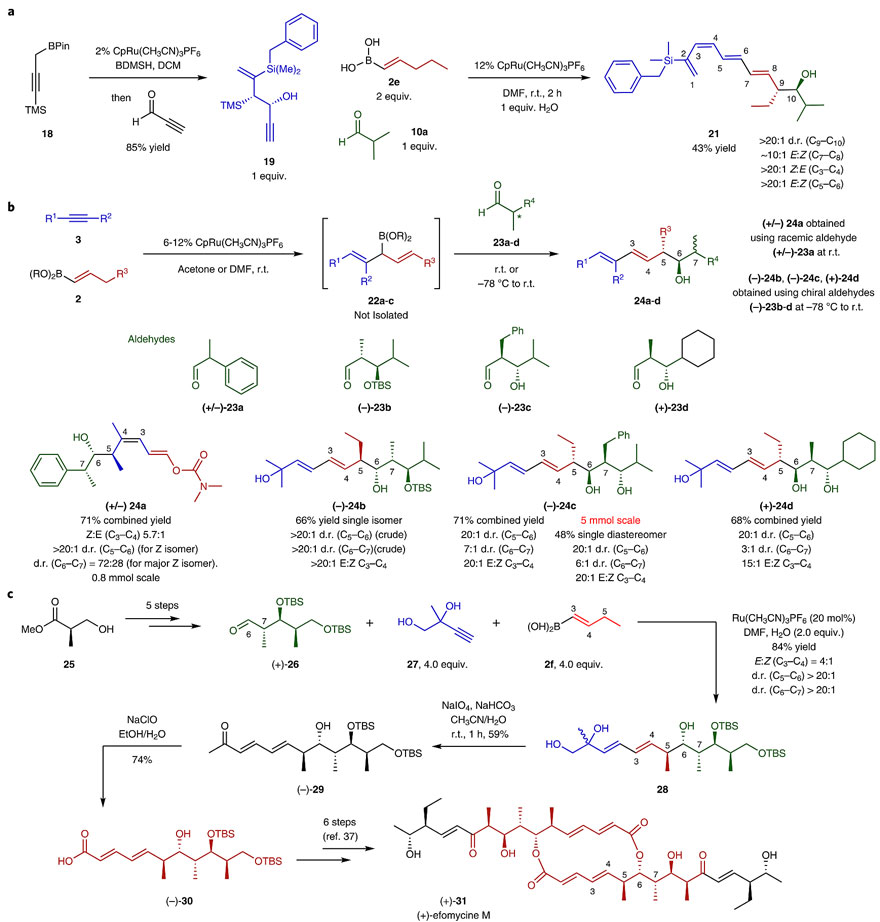
醛底物的扩展及(+)-efomycine M的不对称全合成。图片来源:Nat. Chem.
总结
该方法可以“一锅法”实现两个新的C-C键构筑、两个立体确定的烯烃以及在一次操作中高立体选择性地构筑3个连续sp3手性碳,并用于制备手性产物。此外,对于高度复杂的聚酮类天然产物也能实现原子经济性和步骤经济性的全合成。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ruthenium-catalysed multicomponent synthesis of the 1,3-dienyl-6-oxy polyketide motif
Barry M. Trost , James J. Cregg, Christoph Hohn , Wen-Ju Bai , Guoting Zhang, Jacob S. Tracy
Nat. Chem., 2020, DOI: 10.1038/s41557-020-0464-x
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号