钌催化二芳基或大位阻酮与铵盐的不对称还原胺化
手性二芳基甲胺和大位阻胺在天然产物、药物和许多活性生物分子的合成中具有十分重要的应用。此外将其作为手性砌块用于配体和催化剂的设计也受到了合成化学家们的青睐(Figure 1)。因此,高效高对映选择性的合成这两类手性胺已引起了越来越多的关注,但仍然具有很大的挑战。
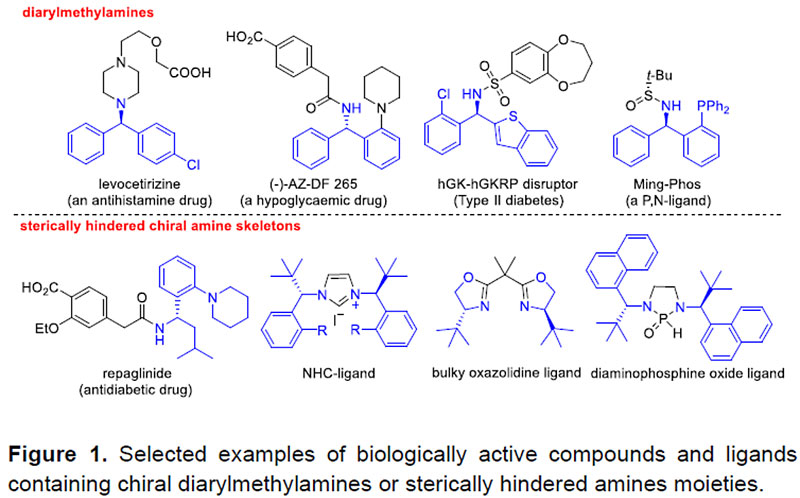
目前已报道的合成方法主要有外消旋体的拆分、芳基金属或芳基硼试剂对亚胺的不对称加成以及为数不多的几例亚胺的不对称还原。然而拆分往往效率低下,后两种方法一般需要预先制备不太稳定的亚胺中间体,原子及步骤经济性欠佳。相比之下,对广泛存在的酮进行不对称还原胺化(ARA)无疑是合成手性胺最直接、最高效的方法之一。虽然过渡金属催化酮(羰基上至少含有一个相对较小的烷基取代基)的ARA已被大量研究(Scheme 1,eq 1),二芳基酮或大位阻酮直接的ARA反应却未有报道(Scheme 1,eq 2-3)。其挑战主要在于:(1)由于空间位阻和亲电性的减弱导致亚胺中间体较难形成;(2)生成的亚胺中间体E/Z构型异构体的相互转化导致对映选择性难以调控;(3)在手性控制时区分两个空间相似的芳基或大位阻基团存在一定的挑战;(4)过渡金属氢物种与酮底物的不兼容以及胺化产物对金属催化剂毒化抑制作用。
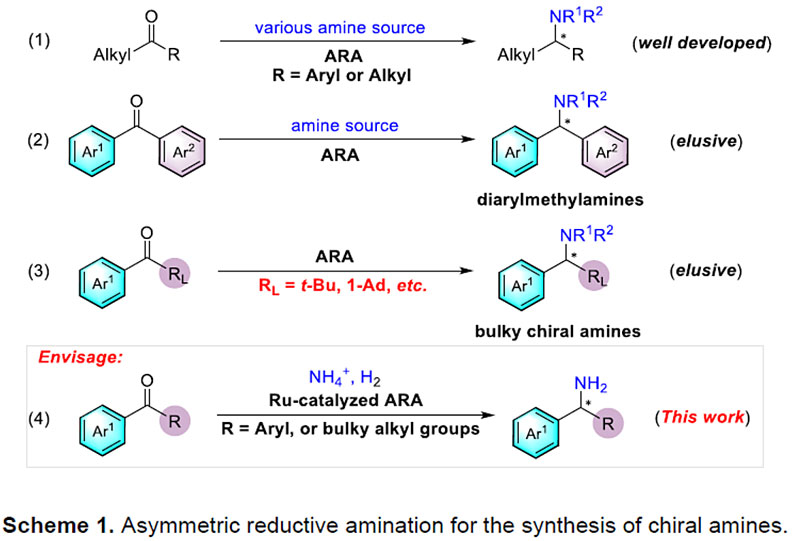
此外,先前报道的大多数ARA反应通常使用芳胺或者苄胺作为胺源,得到的产物是手性二级胺,需要通过较为繁琐的步骤脱去N保护基,从而得到更有合成价值的手性伯胺。考虑到原子和步骤经济性,发展过渡金属催化的使用廉价易得的铵盐作为胺源的ARA反应,一步构建手性伯胺的方法无疑具有重大的优势,但相关研究仍有待开发。
近日,南方科技大学张绪穆(点击查看介绍)和殷勤(点击查看介绍)教授团队在课题组先前工作(J. Am. Chem. Soc., 2018, 140, 2024; Angew. Chem. Int. Ed., 2018, 57, 14193)的基础上,首次报道了钌催化下,铵盐作为胺源,邻羟基取代的二芳基和大位阻酮的ARA反应,实现了多种具有价值的手性伯二芳基甲胺和大位阻的苄胺衍生物的合成(产率高达97%,ee高达93-99%)。此外,通过对产物进行简单的后期转化,即可获得一些更具价值的药物中间体,活性化合物或手性配体。

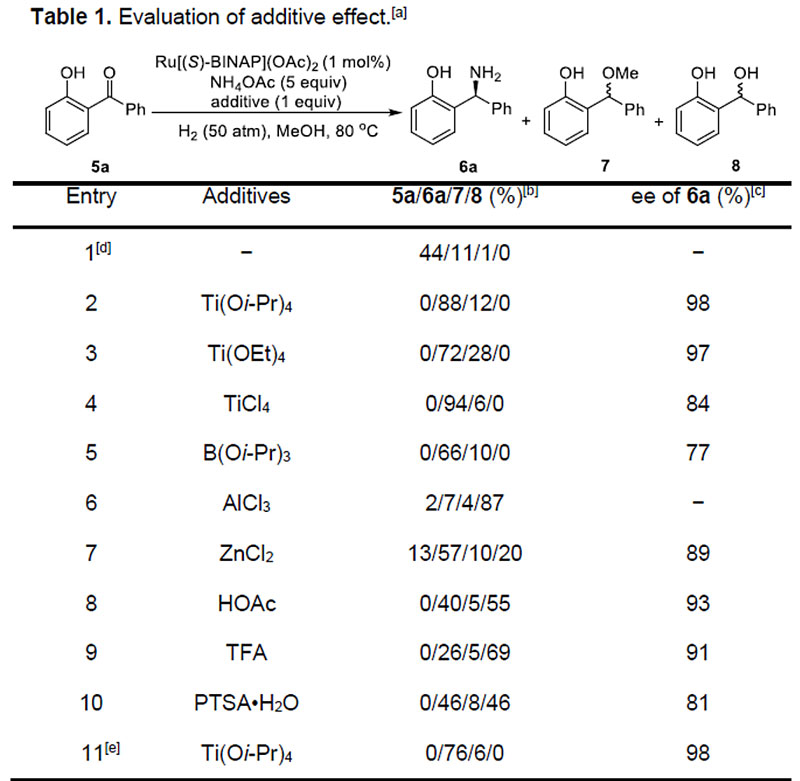
作者首先采用邻甲基二苯甲酮1在先前报道的条件下加入一当量Ti(Oi-Pr)4进行初步尝试,不出所料,反应仅获得少量的目标产物2,同时大量底物未参与反应。而当使用富电子的酮底物3时,尽管能获得中等收率的产物4,但几乎消旋。受相关文献的启发,作者设想,在底物中引入邻位羟基,通过分子内氢键的作用,不仅可以活化酮羰基加速亚胺的形成,而且分子内氢键的存在可以稳定生成的亚胺中间体。同时,由于分子内氢键或路易斯酸配位方式使得亚胺只能以E式异构体形式存在,从而有利于亚胺还原时的手性控制(Scheme 2)。令作者高兴的是,当使用邻羟基取代的底物5a时,反应可以以85%的收率和98% ee获得手性伯胺产物6a。

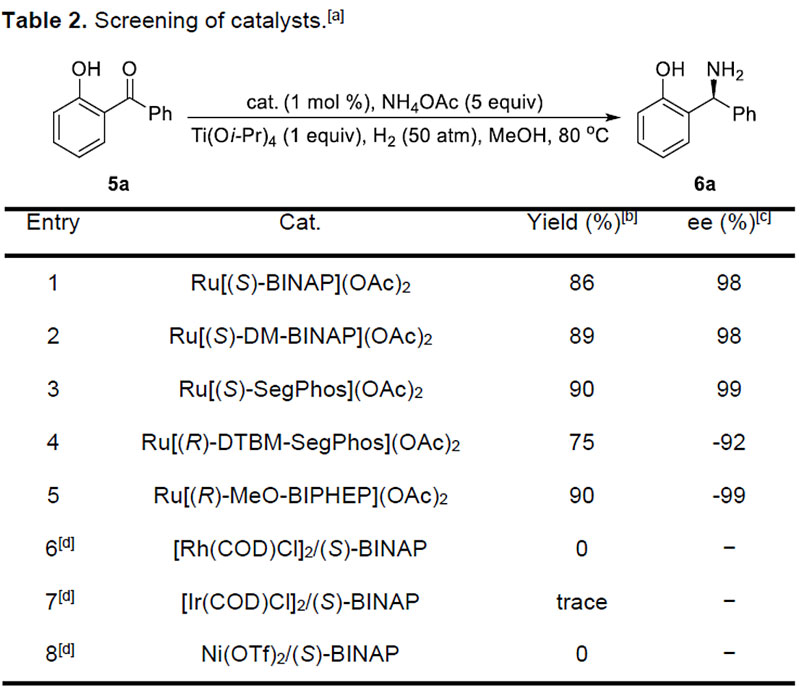
随后,作者以5a为模板底物,对反应条件进行了详细筛选。最终确定反应的最优条件为:底物,1 mol % Ru[(S)-SegPhos](OAc)2, 5 equiv NH4OAc, 1 equiv Ti(Oi-Pr)4在MeOH溶剂中于50 atm氢气压力下80 ℃反应24 h.
在获得上述最佳反应条件后,作者首先对二芳基酮底物5范围进行了考察(Table 3)。反应结果表明,芳基取代基本不受供电子基团(Me、MeO等)和吸电子基团(F、Cl、Br、CF3、COOMe等)的影响,均可获得较高对映选择性(93-99%ee)以及较好收率(55-97%)的目标产物。值得一提的是,该反应体系甚至可以区分两个邻位均有取代的空间大小几乎一样的芳基基团(5b、5e、5j),相应产物(6b、6e、6j)的ee值均在97%以上。此外,具有强配位性原子的杂芳基底物(5t-5u)也与体系兼容。
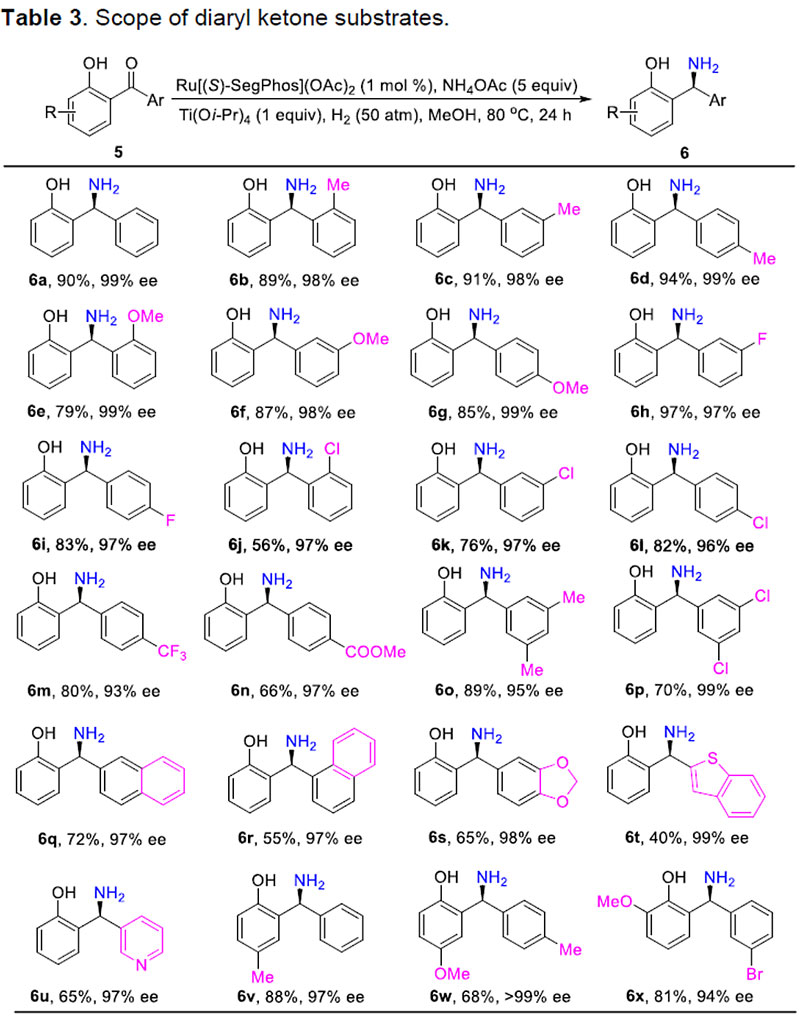
随后,作者进一步将底物扩展到具有大位阻的单芳基酮底物5(Table 4)。反应结果表明,含有苄基(5y)、2-异丁基(5z)、异丙基(5aa)、环己基(5ab)、叔丁基(5ac)甚至金刚烷基(5ad)的底物,均可以较优异的产率及对映选择性(收率82-94%,98-99% ee)获得相应的手性胺产物。同时,作者发现,当使用缺少羟基的底物5ac'进行反应时,未发现目标产物的生成,进一步说明了邻羟基基团对于反应的重要性。
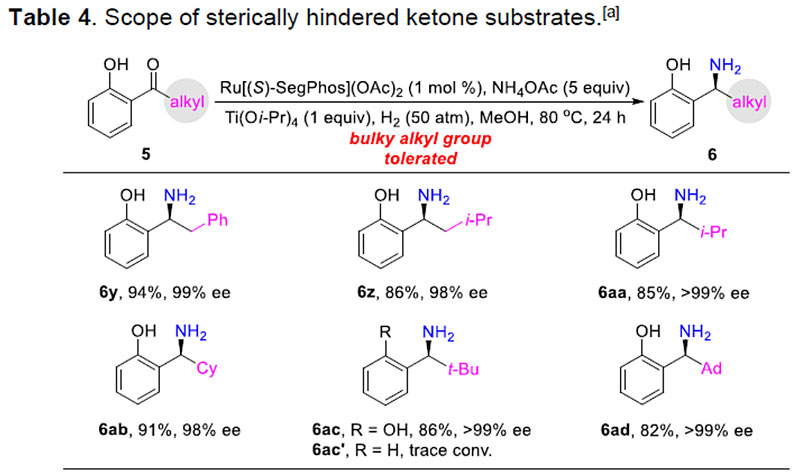
此外,为了说明该反应在合成上的应用,作者对产物进行了相关的修饰,从而进一步证明该反应的实用性(Scheme 3)。利用可移除可转化的羟基,作者高对映选择性地合成了左西替利嗪(抗过敏药)的关键手性中间体11及存在于多种生物活性分子和天然生物碱中的结构单元NH异吲哚啉酮14。
最后,作者还尝试了将获得的产物应用于手性配体的合成(Scheme 4)。作者首先以5ac作为底物,进行了克级反应,以70%收率及>99% ee得到手性胺化合物6ac。紧接着,6ac与丙二酰亚胺二乙酯二盐酸盐缩合后,以高对映选择性获得手性苯并二恶嗪产物15,作为一种新型配体骨架。

总结
南方科技大学张绪穆和殷勤教授团队首次报道了钌催化下,铵盐作为胺源,邻羟基取代的二芳基和大位阻酮的直接不对称胺化还原反应,高效高对映选择性地合成了多种具有价值的手性伯二芳基甲胺和大位阻的苄胺衍生物(产率高达97%,ee高达93-99%)。此外,克级实验、手性药物左西替利嗪中间体、异吲哚啉酮化合物以及新型苯并恶嗪配体的合成,进一步证明了该方法的实用性。
这一成果已于近期发表在Angew. Chem. Int. Ed.。文章第一作者是南方科技大学和澳门大学联合培养博士研究生胡乐安,第一通讯单位为南方科技大学格拉布斯研究院和化学系,通讯作者为殷勤研究副教授。该工作得到了国家自然科学基金和深圳市科创委的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ruthenium‐Catalyzed Direct Asymmetric Reductive Amination of Diaryl and Sterically Hindered Ketones with Ammonium Salts and H2
Le'an Hu, Yao Zhang, Qing‐Wen Zhang, Qin Yin, Xumu Zhang
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.201915459
导师介绍
殷勤
https://www.x-mol.com/university/faculty/50187
张绪穆
https://www.x-mol.com/groups/zhang_xumu
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号