光催化环张力释放,驱动sp3碳自由基环丁烷化反应
近年来,官能团化环丁烷的合成引起了化学家们的广泛关注,因为它具有在构象上是刚性的骨架,并可用于构建结构复杂的分子。图1A中给出了几种含有环丁基结构的药物分子。与常见的含有环己烷、环丙烷等上市药物相比,关于环丁烷的药物分子则相对较少,因此直接迅速地实现环丁烷的烷基化将会大大扩展药物开发项目中探索的空间。通过分子张力的释放发展新的合成方法,这一策略引起了化学家们极大的兴趣,双环[1.1.0]丁烷(BCB)骨架具有64 kcal/mol的环张力能,并且具有特殊的反应活性,可作为相应烯烃的替代物,加成后会生成环丁烷类的衍生物。

图1. 具有环丁基结构的药物分子。图片来源:Angew. Chem. Int. Ed.
最近,巴黎萨克雷大学的Jean-Christophe Cintrat等研究者在可见光条件下,利用光氧化还原催化的方法使底物脱羧形成烷基自由基,实现了与高度环张力的苯磺酰双环[1.1.0]丁烷的加成,成功地合成了一系列的环丁烷衍生物。该方法具有广阔的底物范围,适用于多种α-氨基酸或α-氧羧酸。此外,动力学研究和DFT计算详细地揭示了双环[1.1.0]丁烷与相应烯烃体系反应活性的区别。该文章发表于Angew. Chem. Int. Ed. 杂志。
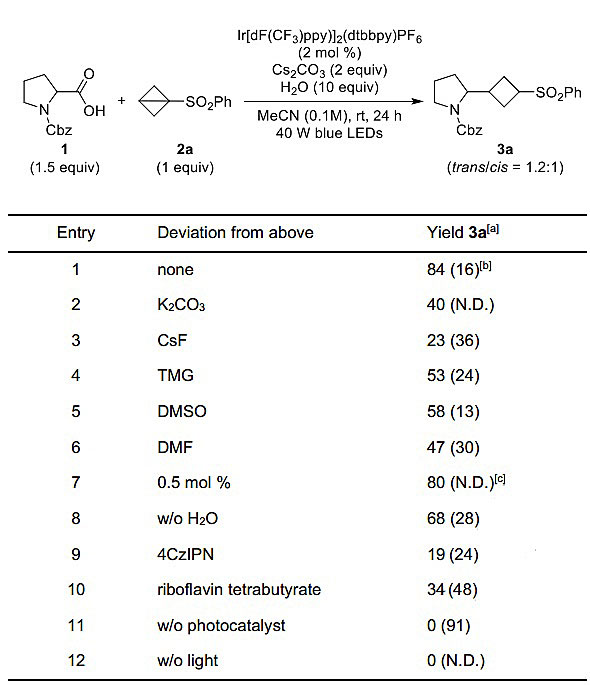
图2. 条件的筛选。图片来源:Angew. Chem. Int. Ed.
作者最初以N-Cbz保护的脯氨酸1和BCB 2a作为反应的底物进行了研究(图2)。经过碱和溶剂的筛选,在40 W蓝光LED灯照射下,Ir[dF(CF3)ppy]2(dtbbpy)PF6作为光催化剂,MeCN为溶剂,1与Cs2CO3形成的铯盐脱CO2后与2a发生了加成反应,以84%的收率得到环丁基产物3a,并且没有观察到非对映体的生成。0.5 mol %的光催化剂足以促使该反应在1 mmol的规模下高效地进行,水对该反应的收率至关重要,无水条件下的收率降至68%。其可能的原因是,一方面水有助于碳酸铯的溶解,另一方面它能为形成的阴离子中间体提供一个质子。最后,对照实验表明光催化剂和可见光对于该反应都是必不可少的因素。

图3. 底物的范围。图片来源:Angew. Chem. Int. Ed.
在确定了最佳反应条件后,作者对BCB的底物范围进行了考察(图3)。BCB结构中苯环上无论是带有吸电子取代基4还是给电子基5,反应均能顺利的进行,但是后者收率略微下降;采用吸电子能力较弱的芳基亚砜6代替相应的芳基砜3a,收率为55%。此外,该反应也能够兼容BCB羧酸衍生物,以较高的收率得到相应的加成产物7和8。

图4. 底物的范围。图片来源:Angew. Chem. Int. Ed.
随后,作者对羧酸的范围进行了拓展(图4)。首先对脯氨酸上α-氨基保护基进行了探讨,N-Boc和N-Bac保护的脯氨酸反应性相似,以极高的收率得到目标产物环丁基衍生物3b和3c;在相同条件下,N-Piv保护的脯氨酸仅以58%的收率得到加成产物3d;N-Boc保护的哌啶、氮杂环丁烷、吗啉和哌嗪等底物也能很容易地进行这一转化,并且以68-98%的高收率生成产物9-12。由于底物N-Boc保护的硫代吗啉的溶解度较差,反应中以DMSO代替MeCN,结果以53%产率得到加成产物13。反应对α-氨基自由基非常敏感,当底物中含游离NH时,反应效果较差,1,3-二取代环丁烷15的分离收率仅为42%且原料有大量剩余,当使用DMA作为溶剂时,15的收率上升到67%,因此对于含游离NH的底物,溶剂的选择至关重要。
对氨基酸的进一步探索表明,通过对反应条件的轻微改变,该方法对N-Boc保护的二级氨基酸—丙氨酸、苯丙氨酸、半胱氨酸和谷氨酰胺均兼容(16-19)。N-Boc保护的谷氨酸5-苄酯和苄基保护的组氨酸也能够兼容该反应,分别以59%和88%的收率得到产物20和21。值得注意的是,N-Boc色氨酸中未保护的吲哚部分对该方法也具有耐受性,以34%的收率得到22。该反应在氟、羟基和羰基取代基(23-25)以及四氢异喹啉(26)存在下也能很好地进行。四氢呋喃-2-甲酸和四氢吡喃-2-甲酸对该方法也适用,分别以48%和42%的收率得到29和30。
为了证明此方法在分子后期官能团化方面的潜力,作者对更复杂的自由基前体进行了考察。二肽Z-Gly-Pro-OH(31)、四肽分子(32)以及降压药物Valsartan(33)和Ramipril(34)在反应中均能顺利地发生相应的转化。最后,作者还通过不同的转化展示了芳砜基在合成中的作用(图5)。在温和的还原性条件下(Mg、MeOH),苯基砜很容易被脱去,从而实现对底物的环丁基化(35);利用苯基磺酰基相邻质子的酸性,形式上实现了烯丙基对苯磺酰基的取代(36)。
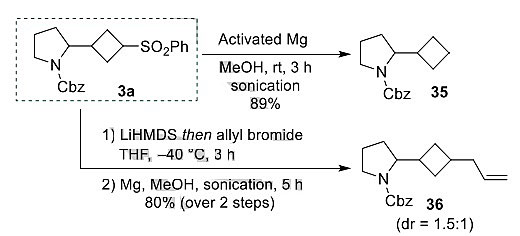
图5. 后期官能团化的应用。图片来源:Angew. Chem. Int. Ed.
光氧化还原脱羧共轭加成的机理如图6所述,激发态光催化剂和羧酸盐I之间通过单电子转移生成羧基自由基II,随后脱去CO2形成烷基自由基III,它对BCB 2a加成后,由于环张力的释放导致C-C键之间的σ-键断裂,生成α-砜自由基IV,还原态的光催化剂对中间体IV还原生成阴离子V,它得到一个质子生成最终产物3a。氘标记实验进一步证实了该反应过程,在重水的存在下,产物3a中α-砜位置含有72%的氘,从而确认了反应经历阴离子V的过程。
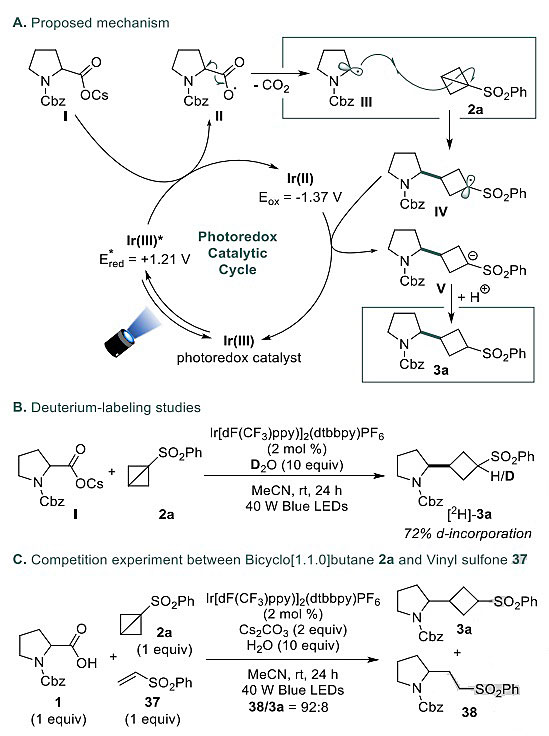
图6. 反应的机理。图片来源:Angew. Chem. Int. Ed.
作者将2a的反应活性与苯基乙烯基砜37进行了比较,在竞争实验中,烯烃37比2a反应性更强,产物38和3a的比例为92:8。动力学研究表明,自由基与乙烯基砜的加成在0.5小时内完成,而与BCB加成则需要几个小时。采用密度泛函理论(DFT)对实验结果进行了验证,并对反应活性差异的原因进行了分析。
总结
Jean-Christophe Cintrat课题组以双环[1.1.0]丁烷作为高张力释放合成环丁烷的基本骨架,在可见光诱导的条件下形成了新的C(sp3)-C(sp3)键,该方法为烷基环丁烷的合成提供了一个简便的方法,该反应条件温和,对一系列不同的官能团均具有较好的耐受性,适用于复杂分子的后期衍生化。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photochemical Strain-Release-Driven Cyclobutylation of C(sp3)-centered Radicals
Guillaume Ernouf, Egor Chirkin, Lydia Rhyman, Ponnadurai Ramasami, Jean-Christophe Cintrat
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201908951
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号