JACS:Cr/光氧化还原共催化系统助力1,2-氨基醇合成
1,2-氨基醇是各种天然产物、药物活性分子和特殊配体的重要单元。据统计,已知含有该结构的化合物超过30万种,其中包括超过2000种的天然产物、80种FDA批准的药物和100种候选药物,因此其合成受到了有机化学研究者的广泛关注。通常情况下,1,2-氨基醇由胺类化合物与环氧化合物的亲核开环反应来制备(图1a)。然而,环氧化合物的反应活性高且通常难以制备,使得该方法的选择性和后期适用性存在一定的缺陷。此外,根据逆合成分析,1,2-氨基醇还可以通过碳负离子对羰基进行加成,但这种方法目前仍未开发,这是因为α-氨基碳负离子上的N孤对电子与碳负离子之间的不稳定相互作用,使其难以对羰基进行加成。另外,α-氨基碳负离子通常由锡化物或有机锂化物通过金属转移来形成。由于含锡原料、副产物的毒性以及有机锂化物的高反应活性带来的官能团耐受性和原子经济性等问题,使得这种方法具有很大的局限性。
与有机锂化物相比,铬类有机物作为亲核试剂在羰基官能团化方面具有明显的优势。最重要的是,这些反应对醛具有高度的化学选择性,并能耐受其它亲电的官能团,如酮、酯基和氰基。其中最具有代表性的当属Nozaki-Hiyama-Kishi(NHK)反应,即将原位生成的Cr有机物加成到羰基上。尽管经典的NHK反应可以生成各种Cr有机物,但合成烷基-Cr试剂仍然是一个难题。近年来,K. Takai 课题组(J. Org.Chem., 1989, 54, 4732–4734)、R. A. Shenvi课题组(J. Am. Chem. Soc., 2018, 140, 16976–16981)以及P. S. Baran课题组(J. Am. Chem. Soc., 2019, 141, 6726–6739)先后实现了烷基-Cr试剂的合成,分别实现了醛与卤代烷、烯烃以及活化的羧酸的化学选择性烷基化反应,但是反应的不足之处在于使用化学计量的铬盐。
2018年,德国明斯特大学的Frank Glorius(点击查看介绍)课题组报道了Cr/光氧化还原双催化的醛的非对映选择性烯丙基化(J. Am. Chem. Soc., 2018, 140, 12705–12709)。在此基础上,他们利用Cr/光氧化还原双催化的体系,以羰基化合物和α-硅基胺作为底物,通过原位生成α-氨基烷基铬作为亲核的碳负离子等价物,合成了一系列1-保护基-2-氨基醇化合物。这种方法拓宽了铬催化的羰基烷基化反应的范围,为1,2-氨基醇的制备提供了一种新的合成策略,相关成果发表于J. Am. Chem. Soc. 期刊上。
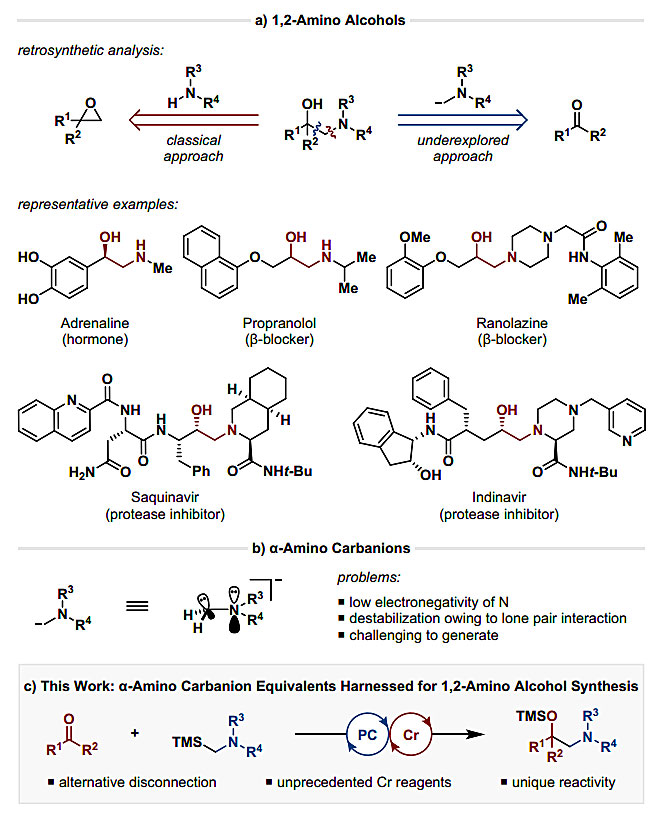
图1. 1,2-氨基醇的合成。图片来源:J. Am. Chem. Soc.
作者以醛1a与α-硅基胺2a作为底物,在可见光照射下,以有机染料4CzIPN和CrCl2作为催化剂进行反应(图2)。值得注意的是,反应2 h后,在各种极性非质子溶剂中均可得到硅基保护的1,2-氨基醇产物3a,其中在DMA中的产率为81%,使用光催化剂[Ir(dF(CF3)ppy)2(dtbbpy)][PF6](Ir-2)可以将收率提高到91%。CrCl3也可以作为催化剂,并且大大提高了该反应的收率(高达99%)。对照实验表明,光催化剂、CrCl3和光对反应至关重要,缺少其中之一都会导致无产物生成,并且反应对水极其敏感,而其他参数(光照强度、温度、浓度、反应规模)对反应产率的影响不大。值得注意的是,该反应以催化循环的方式进行,具有完美的原子经济性,不需要添加剂。
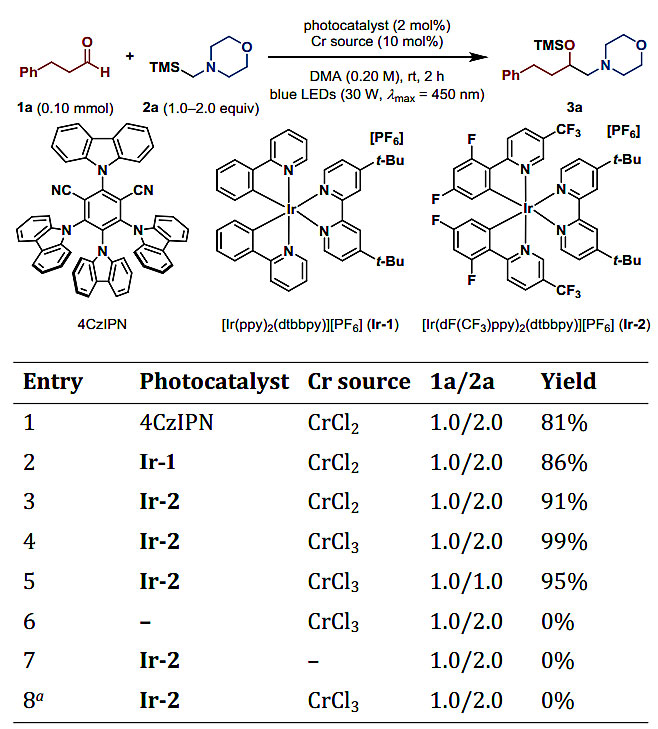
图2. 条件筛选。图片来源:J. Am. Chem. Soc.
在确定了最佳反应条件后,作者对氨基烷基化反应的底物范围进行了考察(图3)。首先,作者考察了胺的底物范围,除吗啉(3a)外,其他重要的N-杂环,如硫代吗啉(3b)、哌啶(3c)和各种哌嗪(3d-3f)都能以中等至较高的收率得到目标产物,尽管3c在分离的过程中会有部分分解。取代的哌啶(3g、3h)和其它大小的环(3i)也能兼容该反应。此外,链状胺(3j-3l)也适用于该反应,其中苄基取代的胺(3l、3m)很容易地去除苄基取代基,生成伯胺和仲胺,从而可以进行随后的官能化。此外,氟西汀(百忧解)衍生物在标准条件下反应也能得到相应的产物3n,表明了这种方法在复杂结构底物的后期官能团化中具有潜在的应用价值。然而,这种方法的局限性在于二级α-氨基烷基铬试剂无法进行该反应,这与上文提到的K. Takai和P. S. Baran课题组所报道的一致。
随后作者对醛的范围进行了考察。一级(3o、3p)、二级(3q、3r)和三级醛(3s)都能适用于该反应,尽管空间位阻较大的底物需要延长反应时间(3s)。与脂肪醛相比,芳香醛类化合物(3t-3v)的产率有所下降,同时伴随着频哪醇偶联产物的生成,可能是底物被光催化剂还原后发生了自由基-自由基偶联。值得注意的是,该反应对多种官能团均具有耐受性,例如带有保护基的胺(3d、3w)和叔胺(3e、3f)、(硫)醚(3a、3b、3m、3x)、烯烃(3y)、缩醛(3z、3ab)和(杂)芳基卤化物(3f、3u)均可用于该反应。此外,当底物中同时存在醛基和酮基(3aa)时,该反应仅对醛基具有化学选择性,即只有醛基官能团化产物生成,未观察到双官能团化产物。
在之前的研究中,烷基-CrIII物种只与醛羰基亲电试剂发生反应,但是该方法也可以用于酮的烷基化。含有硫醚(3aj)、二氟亚甲基(3ak)或螺环缩醛(3al)等官能团的非环状酮(3ac-3af)和环酮(3ag-3ar)均能用于该反应。此外,当不对称的环己酮作为底物时,能够以优异的非对映选择性生成目标产物(3am-3ap),并且该选择性与取代基的位置和空间位阻均无关。由于该催化系统的高反应活性,作者将酰基硅烷作为反应底物并对其进行了考察,在最优条件下,以65%的收率得到了1,2-氨基醇3ar。
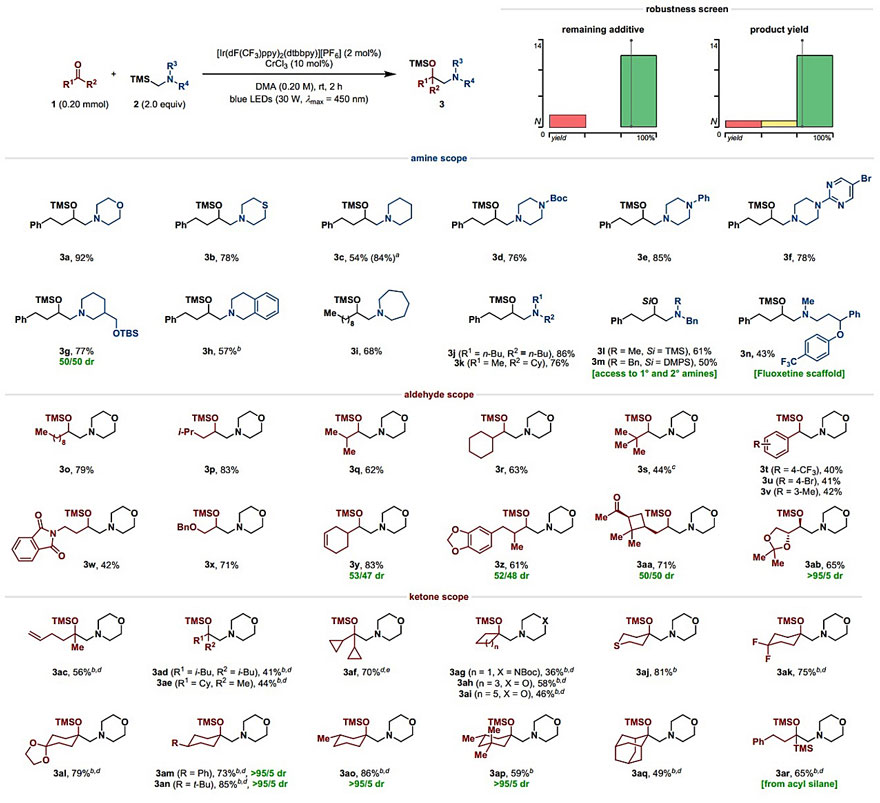
图3. 底物的范围。图片来源:J. Am. Chem. Soc.
最后,作者通过各种实验对反应机理进行了深入的研究。Stern-Volmer荧光淬灭实验表明原料和产物均能淬灭激发态的光催化剂,但α-硅基胺的淬灭常数约为产物的50倍,表明光催化剂由α-硅基胺还原淬灭。该试验中的量子产率为12.5(图4a),表明该反应为链反应机理。考虑到所涉及的反应物的氧化还原电位,α-硅基胺2(E1/2(2•+/2) = 0.4 - 0.8 V)会将LnCrIII还原(E1/2(CrIII/CrII) = -0.51 V),从热力学角度来看这是一个非常不利的步骤,因此该反应不太可能为自由基链反应机理,应该是通过另一种不同于氧化还原步骤的机制进行。作者给出了一个可能的解释,他们认为烷氧基铬II与TMS胺复合物III或α-硅基胺2发生了σ键的复分解反应。也就是说,σ键复分解会生成Cr-胺类物种IV,在失去TMS+后可再生具有催化活性的α-氨基烷基Cr物种I;或者σ键复分解直接生成α-氨基烷基Cr物种I。这些机制仅通过LnCrIII中间体进行,与实验数据一致,对该反应机理的进一步研究仍在进行中。
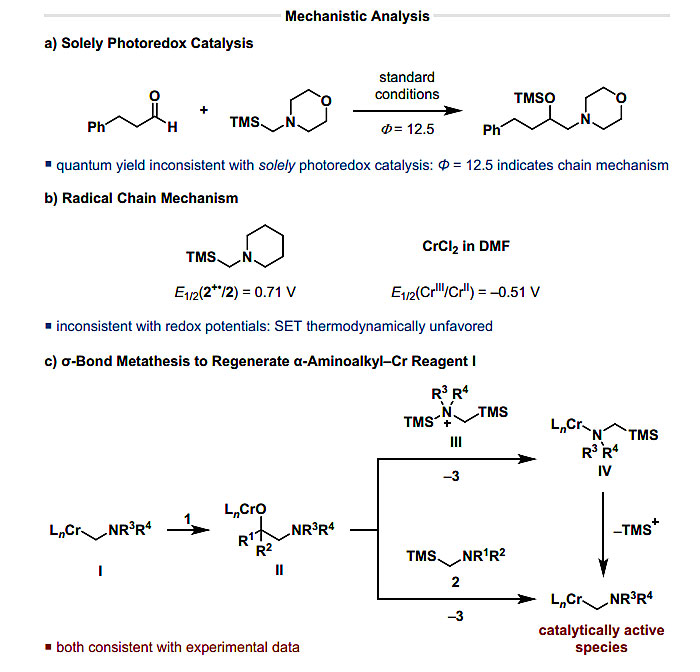
图4. 机理研究。图片来源:J. Am. Chem. Soc.
总结
Frank Glorius课题组通过Cr/光氧化还原双催化系统,以一种温和的、化学选择性的羰基氨烷基化反应,实现了硅基保护的1,2-氨基醇的合成,反应中原位生成了碳负离子的等价物—α-氨基烷基铬试剂。该反应条件温和,底物适用性广,当相应的环氧化合物不易获得时,这种方法可以替代传统的1,2-氨基醇的制备方法。酮类和酰基硅烷的官能团化证明了该双催化系统的独特性质。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

1,2-Amino Alcohols via Cr/Photoredox Dual Catalyzed Addition of α-Amino Carbanion Equivalents to Carbonyls
J. Luca Schwarz, Roman Kleinmans, Tiffany O. Paulisch, Frank Glorius
J. Am. Chem. Soc., 2020, 142, 2168-2174, DOI: 10.1021/jacs.9b12053
导师介绍
Frank Glorius
https://www.x-mol.com/university/faculty/46677
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号