非活化烯烃的位点选择性催化脱氨烷基化反应
通过非活化烯烃的官能团化来构建碳-碳键在现代有机合成中日趋重要,其中,金属氢化物对非活化烯烃的催化加成是当代催化研究中的一个热点,因为它形式上产生了一个潜在的碳亲核试剂,可以与合适的亲电试剂进一步发生反应。由于烷基胺广泛存在于药物和临床前候选药物中,如何设计将催化sp3C-N键裂解技术作为药物发现中先导化合物生成的一种新策略,对于化学家来说是一项新的挑战。尽管已有了一些较好的进展,但C-C键形成方案目前仍局限于一些特定的试剂和底物。
近期,西班牙加泰罗尼亚化学研究所(ICIQ)的Ruben Martin教授(点击查看介绍)课题组设想是否可以用非活化的α-烯烃甚至内烯烃来实现位点选择性催化脱氨烷基化。这不仅可能为探索烯烃官能团化和脱氨反应提供新机会,还有可能发现通过非常规的sp3-sp3键断裂快速和可靠地实现结构多样性的新策略。在作者对Ni-催化反应的持续研究中,他们成功实现了这个目标(图1)。该方法的显著特征是即使在合成后期,对于α-烯烃和内烯烃都能在温和的条件下以优良的化学选择性和优异的位点选择性实现官能团化。虽然在前者中发现了反马氏选择性,但后者能通过链行走实现远程sp3 C-H位点的成键。
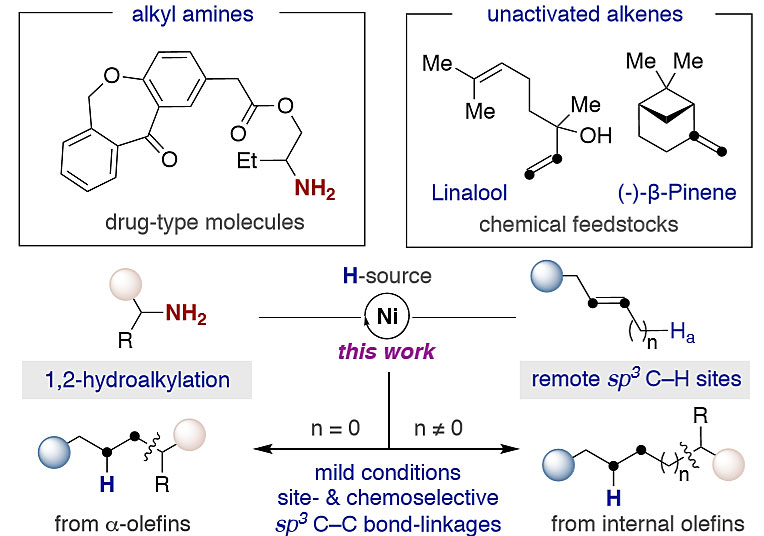
图1. 烯烃的催化脱氨烷基化。图片来源:J. Am. Chem. Soc.
首先,作者以非活化的烯烃2a和容易大规模制备的吡啶盐1a为模型底物,对所有反应结果进行了仔细研究,作者发现,在NiBr2•glyme(10 mol %)、L4(15 mol %)、(EtO)2MeSiH、Na2HPO4和NMP/二氧六环以及40 ℃下反应得到了最佳结果,以80%的分离产率得到了反马氏选择性的3a。在分析的所有配体中,2,2'-双吡啶基元特别适合于靶向转化(图2);与相关的还原偶联反应不同,配体骨架的电子效应以及与氮原子相邻的取代基对于反应的发生并非关键因素。然而,镍预催化剂、氢源、无机碱或溶剂的细微变化都会对反应活性产生不利影响,使得3a产率降低。对照试验表明,所有组分对于sp3-sp3键的形成都是必不可少的。

图2. 反应条件优化。图片来源:J. Am. Chem. Soc.
有了最佳反应条件,作者对底物范围进行了考察,如图3所示,α-烯烃的催化脱氨烷基化反应具有良好的化学选择性,腈(3d)、酯类(3h、3w)、氨基甲酸酯(3n、3s)、硅醚(3c)和酮(3j、3k、3v)的兼容性良好。值得注意的是,有机硼(3g)、烷基卤化物(3e、3f、3k)或芳基卤化物(3h、3l、3w)都可以很好地兼容该反应,从而通过交叉偶联反应实现进一步的衍生化。即使是游离羟基也不干扰sp3-sp3键的生成(3i、3w)。如预期的那样,具有多个不饱和烯烃底物的脱氨烷基化反应完全发生在取代基较少的烯烃(3q、3r)上。如3q所示,该反应可在2 mmol的规模内进行,且产率不受明显影响。重要的是,1,1-二取代烯烃作为底物也能够兼容该反应(3s-3u),同样,靶向sp3-sp3键的形成可以扩展到除1a以外的环状类似物(3j-k、3n-o和3p)和脂肪族同系物(3v、3w)。
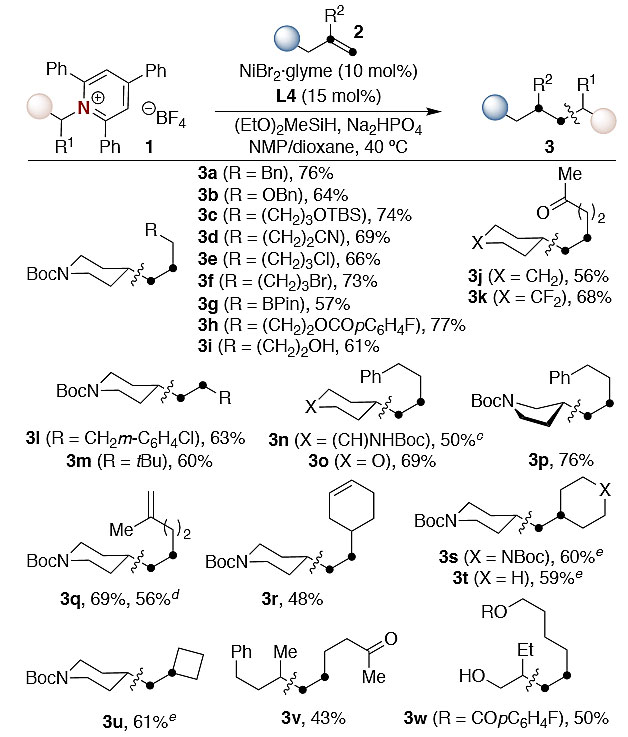
图3. α-烯烃的催化脱氨烷基化。图片来源:J. Am. Chem. Soc.
由于非活化的内烯烃与金属中心的结合力较低,在区分双键两端时存在困难,因此脱氨烷基化能否扩展到内烯烃仍然存在疑惑。事实上,在图3所示的Ni/L4条件下,2-庚烯和1a反应时,没有观察到sp3-sp3键的形成。然而,有趣的是,配体骨架上氮原子附近取代基的加入使得在远端sp3 C-H位发生了脱氨基的sp3-烷基化反应。对反应结果进行合理研究后,底物在DMSO/1,4-二氧六环作为溶剂、NiI2(10 mol %)、L6(20 mol %)、(EtO)3SiH(0.40 mmol)、Na2HPO4(0.80 mmol)条件下反应得到4c,产率57%,选择性> 36:1(图4)。结果表明,硅醚(3c)、邻苯二甲酰亚胺(4e)、醛(4f)、烷基卤化物(3e)、氨基甲酸酯(4i、4j)以及含氮杂环(4g)都能够兼容该反应。重要地是,即使距离双键的位置较远,远端sp3 C-H位仍然能够以较好的位点选择性实现sp3-sp3键的构建(4f)。甚至是带有支链取代基或三取代烯烃(4d)也不影响反应的效率,脱氨烷基化总是发生在位阻较小的sp3 C-H位。
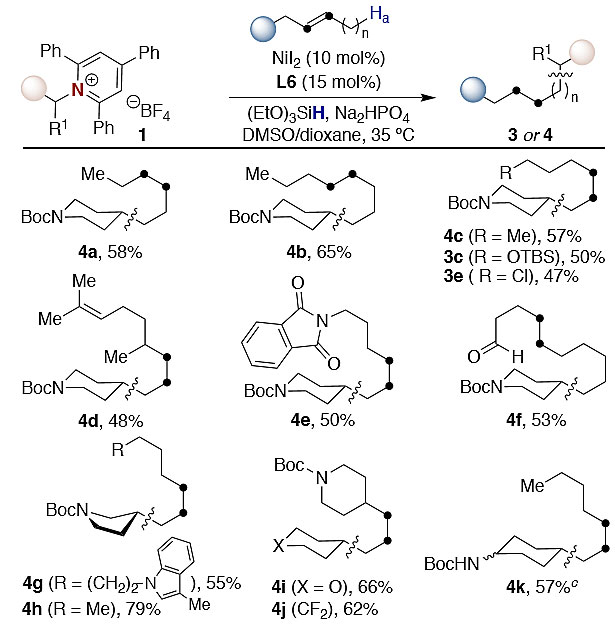
图4. 内烯烃的催化脱氨烷基化。图片来源:J. Am. Chem. Soc.
对于α-烯烃和内烯烃,作者还尝试了该方案在后期官能团化中的应用。如图5所示,尽管在某些情况下只获得了中等的产率,但这些结果解决了合成中的挑战,特别是对于衍生自芳樟醇(5)、paclonburazol(7)、半乳糖(10)或valencene(11)具有多个官能团的底物,C-C键形成仅在最少取代基的烯烃位点发生。类似地,β-pinene(8)、camphene樟脑(9)或雌酮衍生物(6)也能兼容该反应。该反应也可以扩展到氨基酸衍生物(12-15),可以使用伯烷基胺(12-13)或它们的二级同系物(14、15)。特别值得注意的是,该反应得到的15是单一异构体,表明后期脱氨烷基化反应不限于α-烯烃。如14-19所示,本文的方法还可通过与简单烯烃对应物的sp3 C-N键裂解对美西律、异西平和消炎痛进行衍生化。甚至还可以采用诸如20-21的药物型分子来构建sp3-sp3键。
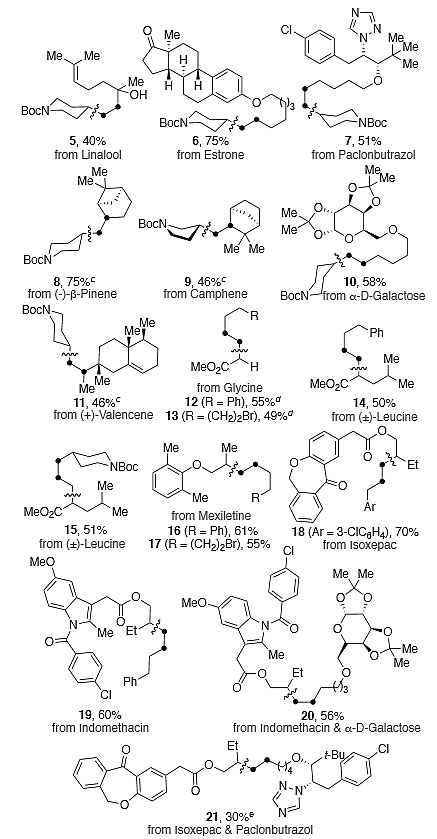
图5. 复杂底物的催化脱氨烷基化。图片来源:J. Am. Chem. Soc.
图6进一步说明了脱氨烷基化的合成应用价值。从N-Boc-4-氨基哌啶(22)出发可以直接获得3a,而不需要分离吡啶盐1a。虽然只有52%的收率,但这一结果表明,简化后者的形成可能是构建sp3-sp3键的一种可行的选择。此外,该反应还可以从烯烃的混合物中实现区域选择性,最终使得4a成为单一的区域异构体。即使是乙烯这种工业上产量最大的化合物,也可以在大气压下(1 bar)反应,顺利得到23。综上所述,图3-6所示的数据证明了作者发展的非活化烯烃的脱氨烷基化反应提供了一种全新的方法构建sp3-sp3键,同时扩展了烯烃官能团化和脱氨化反应。
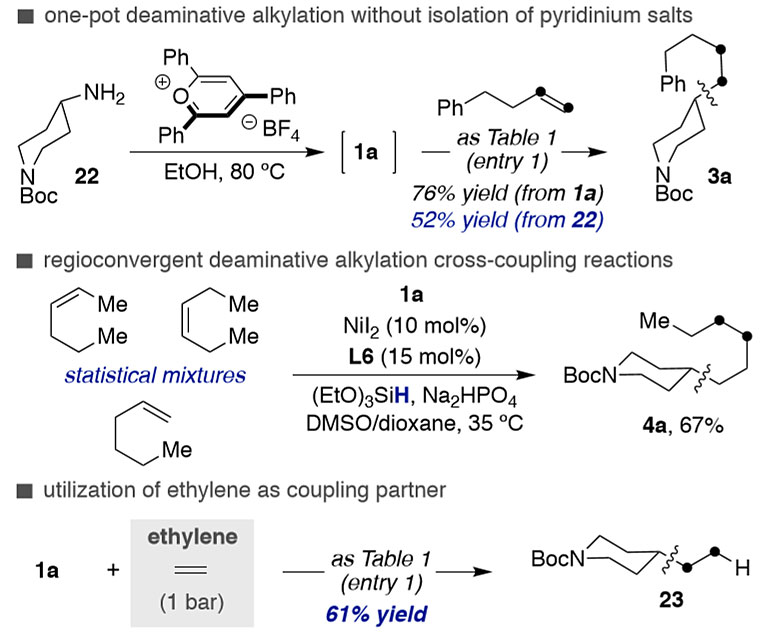
图6. 合成应用。图片来源:J. Am. Chem. Soc.
总结
Ruben Martin教授课题组开发了一种非活化烯烃的催化脱氨烷基化反应,其特点是条件温和、底物范围广、位点选择性优异,对于乙烯或者复杂药物分子的后期衍生化也能适用。这为烯烃官能团化和脱氨反应提供了新的前景,并为现有的sp3-sp3键形成反应提供了补充。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Site-Selective Catalytic Deaminative Alkylation of Unactivated Olefins
Shang-Zheng Sun, Ciro Romano, Ruben Martin
J. Am. Chem. Soc., 2019, 141, 16197-16201, DOI: 10.1021/jacs.9b07489
导师介绍
Ruben Martin
https://www.x-mol.com/university/faculty/44773
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号