南开大学丁丹教授课题组近年来工作概览
副标题:新型分子影像探针的设计、制备与生物医学应用
丁丹教授简介
丁丹,南开大学生命科学学院生物活性材料教育部重点实验室、药物化学生物学国家重点实验室教授、博士生导师。丁丹课题组的研究方向为新型分子影像探针的设计、制备与生物医学应用。课题组主要基于“聚集诱导发光”(AIE)荧光分子等富含分子内运动单元的有机高分子,结合生物医用高分子材料设计、制备新型分子影像探针,探索其在重大疾病诊断与治疗以及疾病发生发展机制研究等方面的生物医用。丁丹于2005年本科毕业于南京大学化学系,2010年毕业于南京大学高分子系并获得理学博士学位,师从蒋锡群教授。其后赴新加坡国立大学化学与生物分子工程系刘斌教授课题组从事博士后工作,在此期间在刘斌教授以及香港科技大学唐本忠院士两位合作导师的指导下完成了AIE材料生物医用领域的最早期探索。2013年进入南开大学任教,2014年10月起先后两次赴香港科技大学唐本忠院士课题组从事访问学者研究。2013年以来,丁丹入选了南开大学“百名青年学科带头人”等培养计划,并获得了国家自然科学基金委优秀青年科学基金项目的资助。

丁丹教授
2013年加入南开大学以来,基于AIE的基本原理,丁丹课题组设计制备了一系列新型的有机高分子光学材料,结合生物医用高分子,发展了能够用于荧光成像、光声成像、以及长余辉发光成像的分子/纳米探针,实现了其在手术导航、干细胞示踪、疾病相关生物分子检测、疾病体内诊断与治疗等生物医用。课题组的研究特色是以Jablonski光物理图为指导方针,通过分子结构设计和生物体系内分子堆积的调控来实现生物医学功能的可控性和最优化;探索激发态分子内运动与生物医学功能和效果之间的内在联系;并且侧重分子/纳米探针对疾病微环境的特异响应性。以下选取丁丹教授团队近5年来的相关文章来介绍其代表性成果。

丁丹教授课题组
(一)通过调控有机高分子光学材料的光物理性质来实现生物医学功能的可控性与最优化
根据Jablonski diagram,分子吸收激发光能量后从基态跃迁到激发态,然后从激发态失活跃迁回基态主要可以分为三种途径:一是“辐射跃迁”即跃迁的过程伴随着光子的放出,产生荧光;二是“非辐射跃迁”即跃迁过程没有光子的参与,激发能量以分子运动产生热量等形式耗散掉(可用于光声成像和光热治疗);三是从激发单重态通过隙间穿越到达激发三重态,处于激发三重态的分子以辐射跃迁的形式释放出磷光,或者将能量转移给环境中的氧分子,通过光氧化反应产生单线态氧等有毒性的活性氧簇(ROS)。因此,对于同一种光学成像材料,因为其所吸收的光能是固定的,这三种能量耗散途径通常是相互影响,相互竞争的。特别是第一种与第二种途径,几乎是对立的。基于此,课题组通过分子结构设计和分子堆积调控成功实现了光物理性质的可控性(图1,图2),使得能够根据生物医用需求通过某一种或两种途径耗散出来,从而实现了最优化的疾病诊断与治疗(Nano Lett., 2019, 19, 318; Nat. Commun., 2018, 9, 1848; Adv. Mater., 2018, 30, 1801065; J. Am. Chem. Soc., 2018, 140, 4945; Adv. Funct. Mater., 2018, 28, 1707140; ACS Nano, 2017, 11, 7177; Adv. Mater., 2016, 28, 7249; Anal. Chem., 2016, 88, 3872; ACS Nano, 2014, 8, 1475)。
荧光成像具有高灵敏度的优点,但是其体内成像的组织穿透深度只能达到毫米级别。另一方面,光声成像突破了传统光学成像的穿透深度极限,能够提供疾病部位的深层次三维信息。因此,光声成像和荧光成像这两种光学成像模式是优势互补的。将光声成像和荧光成像各自的优势应用于肿瘤切除手术导航无疑将为外科医生提供重要的信息。基于此,丁丹教授课题组设计制备了一种新型的功能可转变的有机分子,该分子由光控单元二噻吩基乙烯、AIE基元以及吸电子基团组成。通过简单的外部光照,可以调控分子内二噻吩基乙烯单元的开环与关环,从而使分子吸收的光能能够根据生物医用的需求最大限度地集中用于光声成像、或者荧光成像、或者荧光成像+光动力治疗,实现一个分子多个功能,各个功能之间能够人为可控地进行转变,并且每一个功能都能够实现最大化的功效(图1)。他们将该分子与两亲性生物医用高分子结合,首先制备成具有光声成像功能的纳米探针,然后通过尾静脉将其注射入荷瘤小鼠体内。通过时间依赖的光声成像,能够判断出荷瘤小鼠体内的肿瘤组织大小、个数与深度。然后进行外科手术,在医生切除了肿块后,采用610纳米的红光照射切口部位。如果医生没有完全切除肿瘤组织,还有残余肿瘤组织的存在,残余肿瘤组织中的光声探针就能够在610纳米红光的照射下转变成为荧光探针。利用荧光成像高灵敏度的优点,外科医生能够灵敏地通过点亮的荧光检测到是否有残余肿瘤组织的存在,从而有助于外科医生切除全部的肿瘤组织(Nat. Commun., 2018, 9, 1848)。
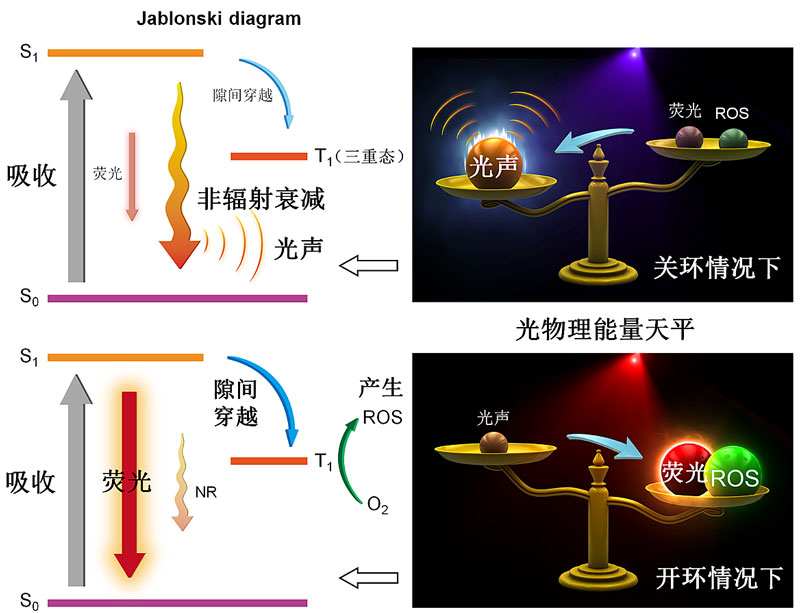
图1. Jablonski diagram。根据生物医用的需求调控光物理能量天平的倾斜,从而实现不同的功能以及每个功能最大化的功效。图片源自:Nat. Commun., 2018, 9, 1848
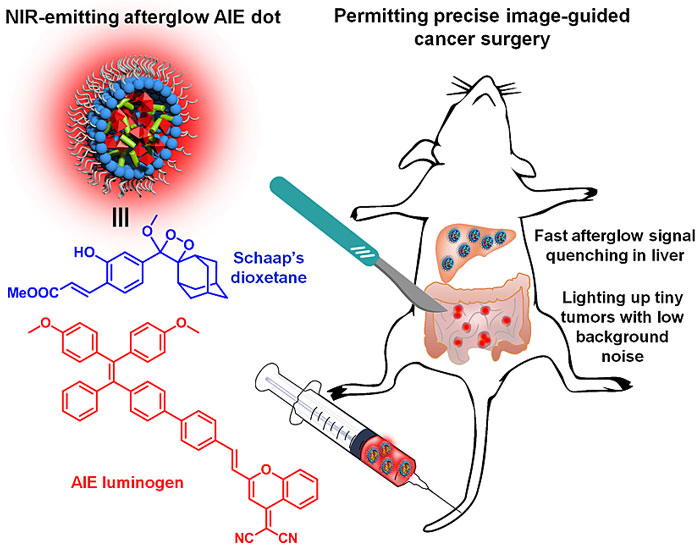
图2. AIE分子“螺旋桨”分子结构及富含分子内运动单元的性质是提高金刚烷-二氧杂化丁烷类材料长余辉发光强度与时间的关键因素。图片源自Nano Lett., 2019, DOI: 10.1021/acs.nanolett.8b03936
(二)基于AIE的基本原理,实现含有“分子内运动单元”的有机高分子材料的生物医用
基于AIE的基本原理,丁丹教授课题组设计制备了一系列新型的有机高分子光学材料,结合生物医用高分子,发展了能够用于荧光成像、光声成像、以及长余辉发光成像的分子/纳米探针,实现了其在手术导航、干细胞示踪、疾病相关生物分子检测、疾病体内诊断与治疗等生物医用(Biomaterials, 2019, 188, 107; Adv. Mater., 2017, 29, 1606167; ACS Nano, 2017, 11, 8998; Biomaterials, 2017, 143, 109; Chem. Sci., 2017, 8, 2191; Chem. Sci., 2017, 8, 2782; Small, 2017, 13, 1602807; Small, 2017, 13, 1604139; Adv. Sci., 2017, 4, 1700310; Chem. Sci., 2016, 7, 5118; Adv. Funct. Mater., 2015, 25, 4263; Mater. Horiz., 2015, 2, 100; ACS Nano, 2014, 8, 12620)。
放射治疗是治疗肺癌、结直肠癌、食道癌等癌症的一线治疗手段。尤其是对于无法切除的肿瘤,放射治疗更是主要的控制肿瘤生长的方法。但是,由于肿瘤细胞对放射射线产生的耐受性常常导致放射治疗的失败。因此,放疗增敏剂的开发成为了癌症放疗领域的研究热点与难点。评价放疗增敏剂增敏效果的重要指标是SER10(sensitizer enhancement ratio at 10% cell survival)值,其值越高说明放疗增敏剂对肿瘤细胞的增敏能力越强。目前最常用的放疗增敏剂有化疗药物例如紫杉醇,顺铂等。然而,放疗联合化疗药物治疗经常导致毒副作用过大,使患者难以承受。最近,许多研究者将兴趣聚焦在无毒副作用的金纳米粒子上,其独特的放疗增敏机制使其成为非常有前景的放疗增敏剂。然而,无论是临床化疗药物,还是金纳米粒子,它们的放疗增敏效果仍有很大的提升空间。因此,寻求更加卓越的放疗增敏剂仍迫在眉睫。针对这一问题,丁丹教授课题组设计了一种基于AIE性质的具有线粒体靶向能力的放疗增敏剂(命名为DPA-SCP)。DPA-SCP能够有效地靶向肿瘤细胞的线粒体,开启红色荧光,并且在白光照射下在线粒体内产生单线态氧。通过优化条件,例如调节白光功率和照射时间等,DPA-SCP在线粒体中产生的单线态氧对肿瘤细胞本身并没有实质性的杀伤作用,但是一旦与放射治疗联手,便能够发挥出远远优于化疗药物和金纳米粒子的协同治疗效果。细胞克隆实验表明,DPA-SCP对肺癌A549细胞放疗增敏的SER10值高达1.62。在相同实验条件下,金纳米粒子的SER10值为1.19, 化疗药物紫杉醇的SER10值为1.32, 证明了DPA-SCP出众的放疗增敏效果。为了进一步探究其机制,他们分析了肺癌细胞中凋亡存活通路中关键蛋白水平的变化。通过实验发现,将DPA-SCP光照处理后再进行放射治疗的实验组,其PI3k/Akt和MAPK两条促存活通路蛋白p-Akt 和 p-ERK都有所降低,而相应的凋亡通路蛋白Bax、Bad和Caspase-3等水平都明显上调。结果表明DPA-SCP光照产生的单线态氧与放射治疗在肿瘤治疗当中具有很好的协同效果。该实验结果与细胞克隆实验相互验证,从机理上进一步做出了阐释(图3)(Adv. Mater., 2017, 29, 1606167)。
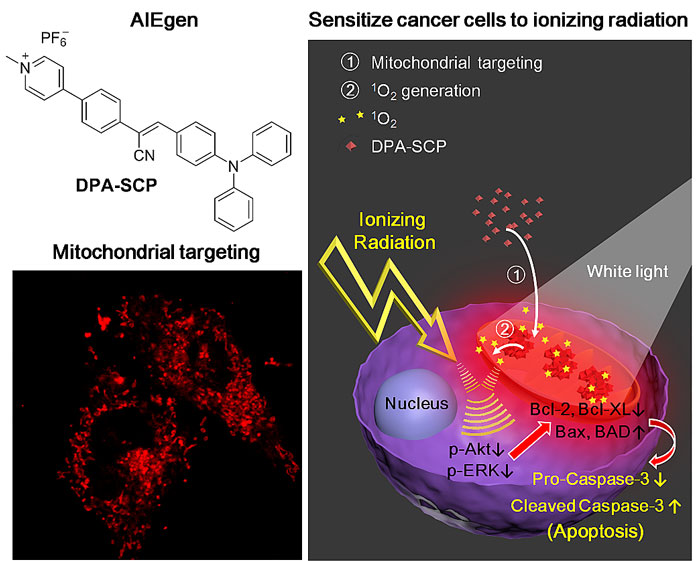
图3. 靶向线粒体的AIE分子能够有效实现放疗增敏,其放疗增敏效果优于紫杉醇和金纳米粒子。图片源自:Adv. Mater., 2017, 29, 1606167
功能细胞特别是内皮细胞的体内示踪一直是细胞治疗领域的一个重要的科学问题。目前,文献中报道的功能细胞示踪策略有两类,一类是采用报告基因标记,另一类是采用外源性标记探针标记。报告基因标记功能细胞的方法尽管准确、灵敏,但是需要复杂的细胞转染操作,并且临床使用的可行性低;另一方面,目前几乎没有外源性探针被证明能够长期准确地报告内皮细胞的体内命运以及报告内皮细胞是如何贡献于再生治疗的。基于此,丁丹教授课题组制备了一系列基于有机高分子材料的纳米探针并将其应用于内皮细胞示踪以及干细胞示踪的研究中。例如,合成的近红外发光的纳米探针在水中的荧光量子产率可高达47%。将该纳米探针应用于内皮细胞的体内示踪中。首先将纳米探针在体外标记内皮细胞,然后将标记后的内皮细胞通过尾静脉或股动脉注射入患有下肢缺血疾病的小鼠中,可以通过荧光成像清晰地观察到内皮细胞随着时间在下肢缺血疾病部位的归巢。通过纳米探针的标记,他们还能够清楚地观察到内皮细胞在疾病部位形成了新生血管,并以此方式来治疗下肢缺血(图4)。此外,由于所制备的纳米探针在近红外区域具有很高的亮度,其最少能够准确示踪通过股动脉注射的2000个内皮细胞。在相同实验条件下,Qtracker655和PKH26无法示踪这么少的细胞。这一结果证实了所制备的纳米探针在细胞体内示踪方面的优越性(Biomaterials, 2017, 143, 109)。

图4. 近红外发射的有机高分子纳米探针能够在下肢缺血疾病小鼠体内长期、准确示踪内皮细胞的命运和功能。图片源自:Biomaterials, 2017, 143, 109
以上为丁丹教授课题组近年来具有代表性的工作成果,其它更多具体详细的信息请参考该课题组的网站:http://www.dinglab.net 或发送邮件至dingd@nankai.edu.cn进一步讨论。此外,该课题组欢迎有志于科研,并对其研究方向感兴趣的同学联系报考硕士/博士以及博士后岗位。
导师介绍
丁丹
https://www.x-mol.com/university/faculty/38300
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号