杜玮、陈应春课题组ACS Catal.:胺/硫共催化的不对称[5+3]环化反应
Morita-Baylis-Hillman (MBH) 产物含有多个官能团,易于通过不同反应转化为多种产物,因而其合成和相关转化被广泛研究。MBH衍生物可在手性叔膦或叔胺等Lewis碱催化下发生多类不对称反应,已经取得了不错进展;然而未加修饰MBH醇的转化,特别是环状烯酮衍生的MBH醇,相关研究却较少。最近,四川大学华西药学院杜玮、陈应春课题组通过金鸡纳碱衍生的手性伯胺和非手性的2-巯基苯甲酸共催化条件实现了环戊烯酮衍生的MBH醇与azomethine imines的不对称[5+3]环化反应,以好的对映选择性构建一系列三环并环骨架。该工作发表在ACS Catalysis上,第一作者为博士研究生杨倩倩。
环状烯酮衍生的MBH醇可在铑催化下发生不对称β-1,4加成/羟基消除反应,同时还可以实现MBH醇的动力学拆分(图1a);中国科学院化学研究所的陈拥军、刘利研究员报道了此类化合物在手性胺催化下与不同的亲核试剂发生γ-或β-位加成(图1b, Angewandte Chemie, 2010, 49, 7294; Adv. Synth. Catal., 2016, 358, 132);随后,国外的Albrecht和Jørgensen教授也在胺催化下实现了MBH醇和3-烯基氧化吲哚的不对称α′,β-[4+2]环加成反应(图1c, Chem. Eur. J., 2014, 20, 13108)。
另一方面,环状的azomethine imines可作为1,3-偶极子和不同的活化烯烃发生不对称[3+2]环加成反应,它们也可以作为两性离子在金属或者有机催化下发生[3+3]或者[4+3]环化反应。基于课题组长期在手性胺催化环状烯酮不对称转化方面的研究,陈应春团队尝试将环戊烯酮衍生的MBH醇和环状的azomethine imines结合起来,发现在手性胺和硫酚共催化下可以很高的对映选择性得到α′,γ-区域选择性的[5+3]环化产物(图1d)。
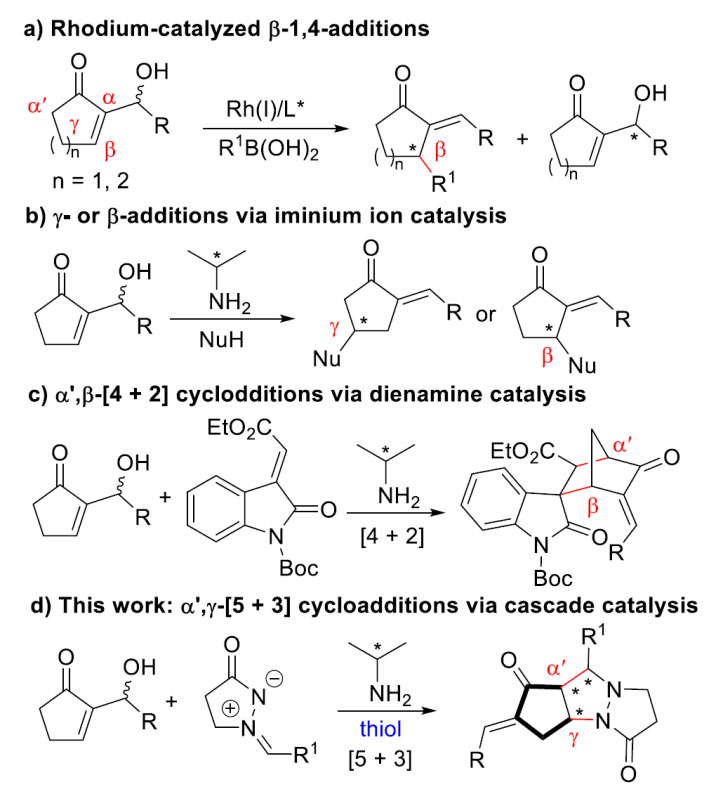
图1. 未修饰的环状MBH醇参与的不同立体选择性的不对称反应以及本文研究工作
在本文研究的条件优化中,作者首先使用金鸡纳碱衍生的伯胺C1作为催化剂,强酸三氟醋酸(TFA)为添加剂,尽管可以生成预期产物4a,但收率和对映选择性都不理想(图2, entry 1),而主要产物为α,β-区域选择性的[3+2]环加成产物-逆aldol反应产物3a。基于课题组前期在胺/硫酚共催化方面(Nat. Chem., 2017, 9, 590; Chem. Eur. J., 2017, 23, 10678; Chem. Commun., 2018, 54, 1129)的研究,作者尝试向反应体系中加入2-巯基苯甲酸T1,以期巯基进攻1a的β-位形成Michael加成中间体,继而促进生成[5+3]环化产物。实验表明:当加入催化量的T1,4a的收率和对映选择性均有较大的提高(entries 3 and 4 vs entry 1)。另外,作者还发现T1中巯基邻位的羧基也对反应起了至关重要的作用(entry 4 vs entries 5-9)。最后,经过对其他参数的筛选,作者确定了反应的最优条件:以胺C3和硫酚T1作为共催化剂,手性磷酸A3为酸性添加剂,均三甲苯为溶剂。
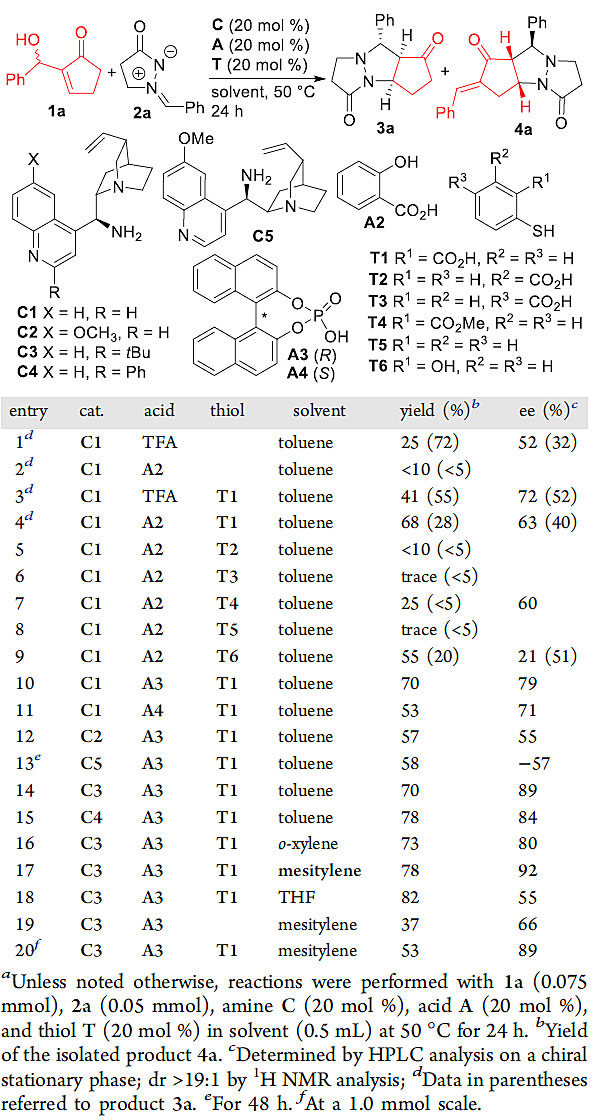
图2. 不对称[5+3]环化反应的条件优化
随后,作者对该不对称[5+3]环化反应的底物适用性进行了考察。从图3中可以看出,芳醛、杂环芳醛以及直链、支链的烷基醛衍生的MBH醇与azomethine imine 2a均可顺利地进行该反应;同时,富电子、贫电子的芳基以及烷基取代的azomethine imines也都能很好地与该反应兼容,底物适用范围很广。
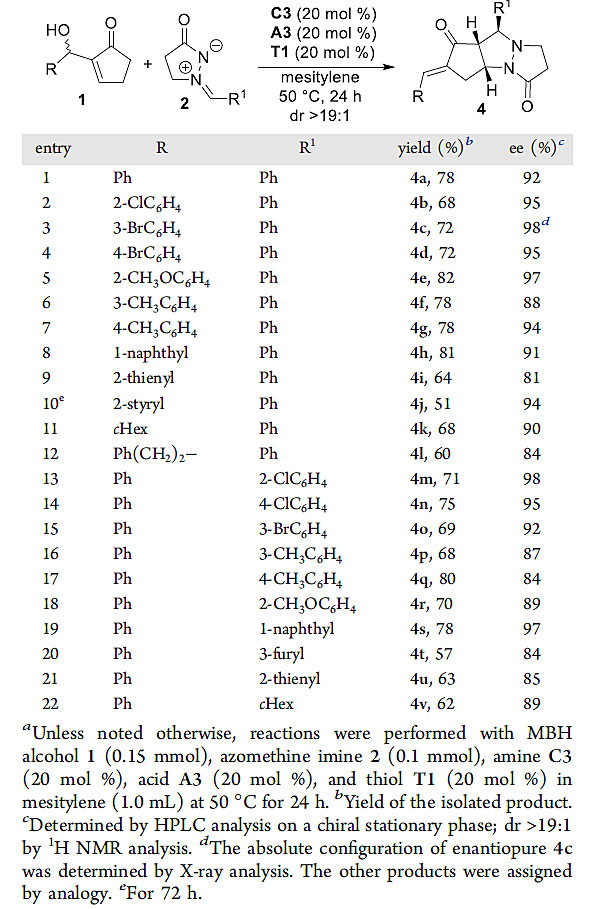
图3. 不对称[5+3]环化反应的底物扩展
多官能团化的环化产物也可转化为更为复杂的分子结构。如图4所示,底物5可原位生成1,3-偶极子与环化产物4a发生偶极环加成,以优异的收率和立体选择性得到螺环骨架6。另外,在1 atm的氢气环境下,可以选择性地还原4a的不饱和烯酮的双键;而当压力升为5 atm时,可以得到手性八元并五元环的双环骨架产物8。
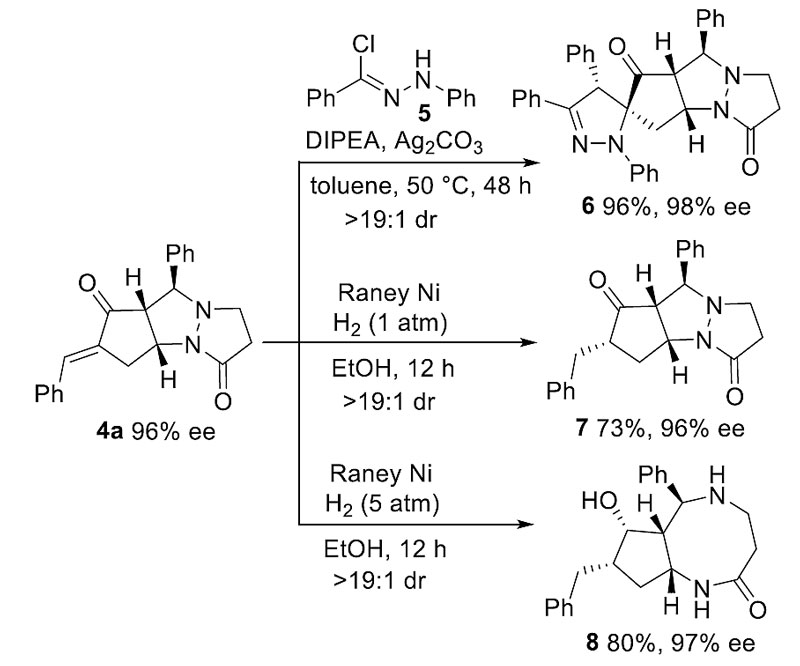
图4. 不对称[5+3]环化产物的转化
为了验证反应机理,作者做了以下对照实验。如图5a 所示,α'-苄叉环戊烯酮9和2a可发生1,3-偶极环加成得到产物4a,但是其收率以及对映选择性都比MBH醇1a与2a反应的结果差,排除了9为反应中间体的可能。在氘代实验中,产物4a的β-H被明显氘代,从而证实反应中β-位会发生质子化(图5b)。作者推测反应机理如图(图5c):首先,2-巯基酸T1与1a发生可逆的β-加成,并脱除一分子H2O得到中间体I,胺催化剂C1与中间体I生成二烯胺中间体II,继而与2a发生α′-选择性的Mannich反应生成III,然后在邻位羧酸根的协助作用下2-巯基酸T1脱除,得到亚胺离子IV,并异构化为4-氨基富烯中间体V,再发生β-质子化生成亚胺盐离子VI,最后在γ-位发生分子内的aza-Michael加成得到环化产物4a。推测的反应机理中所涉及的中间体I、II、III和V均通过高分辨质谱监测到了相应的分子量。
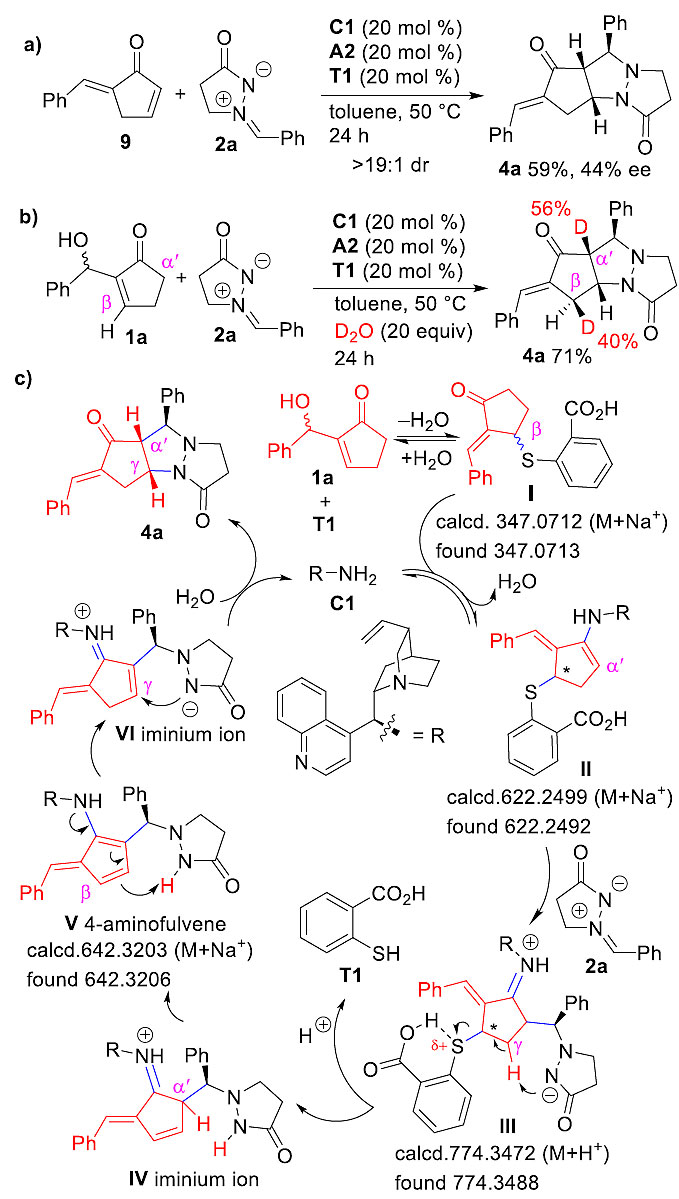
图5. 不对称[5+3]环化反应的机理研究
总结
在该工作中,作者通过胺/硫酚共催化实现了新颖的α′,γ-区域选择的[5+3]环化反应。该共催化体系对反应的化学选择性和对映选择性的控制均起了非常重要的作用,显示硫酚类化合物作为新型有机催化剂可能得到更广泛的应用。该类型环化反应条件温和,官能团兼容性好,以良好到优异的对映选择性构建三环并环骨架,还可更进一步构建更复杂手性骨架分子。
该论文作者为:Qian-Qian Yang, Xiang Yin, Xiao-Long He, Wei Du*, Ying-Chun Chen*
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric Formal [5 + 3] Cycloadditions with Unmodified Morita–Baylis–Hillman Alcohols via Double Activation Catalysis
ACS Catal., 2019, 9, 1258–1263, DOI: 10.1021/acscatal.8b04942
导师介绍
陈应春
https://www.x-mol.com/university/faculty/23511
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号