JACS:光/酮/镍协同实现苄基和脂肪族C-H键与CO2的羧基化反应
在有机合成中,利用二氧化碳(CO2)作为碳源,通过构建碳碳键将CO2引入到有机骨架中一直颇具挑战。尽管各种官能团(例如碳卤键、碳碳双键等)已成功地实现了与二氧化碳的反应,但直接将二氧化碳与烃类化合物进行反应仍存在一定的局限性,仅限于烯丙基、芳基和乙烯基的C-H键。目前还未报道过均相催化剂促进的苄位C(sp3)-H键以及饱和烃C(sp3)-H键直接羧化的反应。
众所周知,在光子激发下,羰基上的氧会从C(sp3)-H键上攫取一个氢原子,分别得到酮基自由基和烷基自由基,这种活化方法已被广泛地用于C(sp3)-H键的直接官能团化。2016年,日本京都大学的Masahiro Murakami(点击查看介绍)课题组在光、二甲苯酮衍生物和铜(I)配合物的协同作用下,实现了烯丙基C-H键与CO2的羧基化反应(Chem. Eur. J., 2016, 22, 6524−6527)。在此基础上,他们最近实现了苄基和脂肪族C-H键与CO2的光致羧基化反应(图1)。在紫外光照射下(λmax= 365 nm),甲苯衍生物在酮、镍络合物和叔丁醇钾的协同作用下,可以捕获气态CO2并生成苯乙酸衍生物;环己烷及其它烷烃在类似的反应条件下也能实现羧基化,生成对应的羧酸。该反应通过将CO2加成到苄基和烷基C(sp3)-H键上实现了碳链的增长。相关成果发表于J. Am. Chem. Soc. 期刊上。
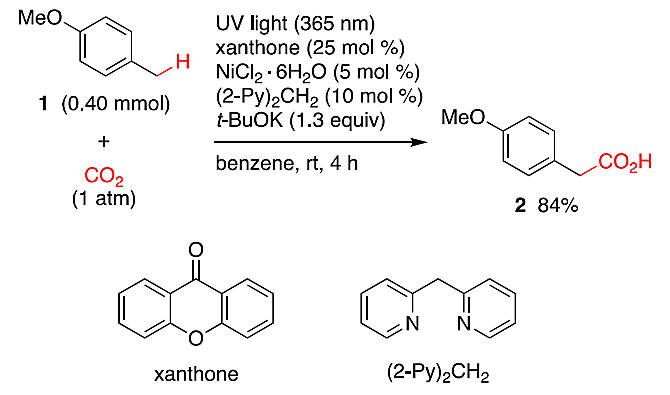
图1. 对甲氧基甲苯的羧基化反应。图片来源:J. Am. Chem. Soc.
图2描述了对甲氧基甲苯1和CO2生成羧酸2可能的反应机理。氧杂蒽酮在紫外光的照射下被激发,激发态的氧杂蒽醌上的羰基氧从对甲氧基甲苯1的苄基碳氢键上攫取氢原子,分别生成电中性的酮自由基和苄基自由基。在t-BuOK的作用下,酮自由基去质子化生成酮基阴离子,随后将单电子转移到催化剂前体Ni(II)盐上。在镍的催化循环中,Ni(0)与苄基自由基结合,生成苄基Ni(I)中间体,随后二氧化碳插入到C-Ni(I)键中,生成羧酸Ni(I),接着从酮基阴离子中得到一个电子,生成2的羧酸盐阴离子以及Ni(0)。然而在反应过程中,由于苄基自由基发生二聚,因此会生成副产物1,2-二(对甲氧苯基)乙烷。
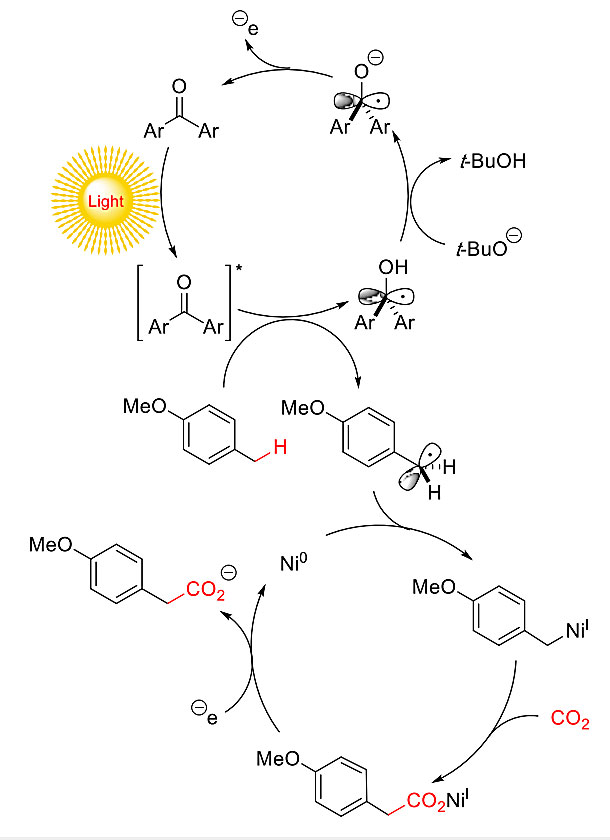
图2. 可能的反应机理。图片来源:J. Am. Chem. Soc.
环丙基甲基苯甲醚3的羧基化反应结果与图2所提出的机理一致。当3在同样的条件下进行反应时,主要产物为环丙烷开环后形成的羧酸4(产率为30%,E:Z = 9:1),并没有生成苄基直接羧基化的产物(图3)。这一结果表明,反应过程中涉及到苄基自由基的形成。
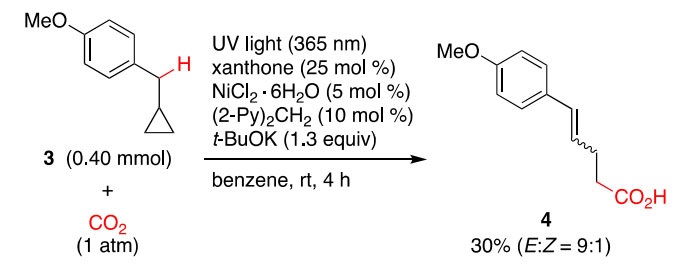
图3. 环丙基甲基苯甲醚3的羧基化反应。图片来源:J. Am. Chem. Soc.
接着,作者对甲苯类底物的兼容性进行了考察(图4)。与对甲氧基甲苯的情况相同,间甲氧基甲苯5的羧化反应选择性地发生在苄基的C-H键上而不是甲氧基C-H键;对二甲苯7选择性地发生单羧化反应,并以75%的收率生成对甲基苯乙酸8,可能是因为生成的羧酸盐在苯中的溶解度低,无二羧化产物生成;间二甲苯9、邻二甲苯11以及均三甲苯13都能够兼容该反应,分别生成了相应的单羧基化产物10、12和14;由于激发态的羰基氧是亲电性的而不是亲核性的,因此它更容易从富电子的C-H键上攫氢,例如3,4-二甲基苯甲醚15选择性地在4-甲基的C-H键上发生羧化反应;4-甲基邻二甲氧基苯17的羧化反应更加高效,以81%的高产率生成18;4-氟甲苯19、4-氯甲苯21和4-甲氧基3-氰基甲苯23同样在4-甲基的C-H键上发生了羧化反应,同时取代基没有发生任何变化;而对于底物4-二甲基氨基甲苯、4-甲硫基甲苯、4-氰基甲苯以及3-苯甲酰甲苯,则无羧基化的产物生成。
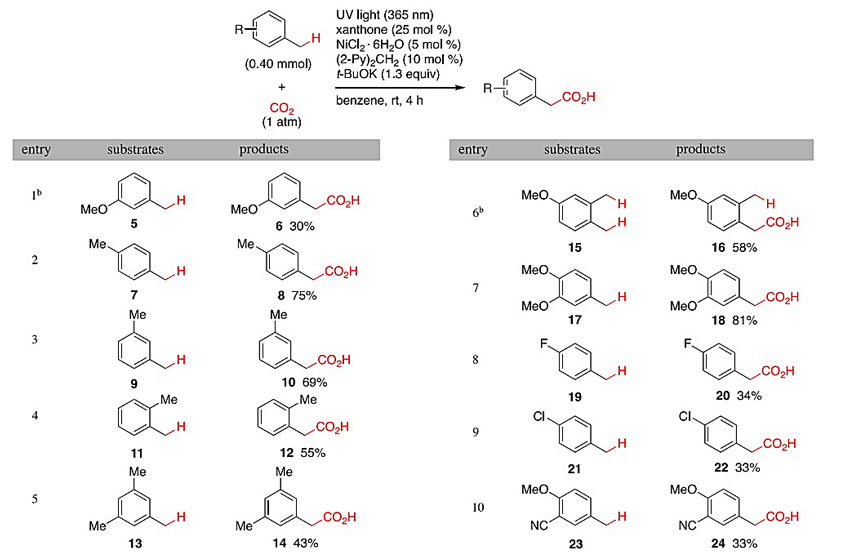
图4. 底物的范围。图片来源:J. Am. Chem. Soc.
如图5所示,当用乙苯25作为底物进行羧基化反应时,以15%的收率生成羧酸26,同时生成了2,3-二苯基丁烷(产率:17%;dr:1:1)。苄位上甲基的存在会使苄基自由基更稳定,也就是说其反应活性更低,同时位阻也会影响其与Ni(0)的偶联,因此生成了更多的苄基二聚化产物。而在此反应条件下,环己烯则未能成功地实现羧基化反应。可能是由于C–C双键与镍配位,阻碍了环己烯自由基与Ni(0)的偶联。
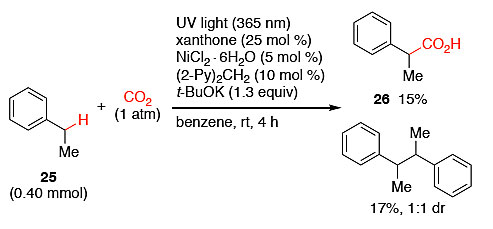
图5. 乙苯的羧基化反应。图片来源:J. Am. Chem. Soc.
随后,作者尝试了饱和烃的羧化反应。将类似于图3的反应条件应用于环己烷27时,仅观察到微量的环己烷甲酸28生成。对反应条件进行优化,得到了最佳的反应条件:即环己烷27(1 mL)、酮29(0.10 mmol)、Ni(NO3)2•6H2O(0.01 mmol)、联吡啶30(0.02 mmol)、t-BuOK(0.40 mmol)以及t-BuOH(4 mL)在UV LED灯下照射时,生成0.32 mmol环己甲酸28(图6)。以t-BuOK(0.40 mmol)作为参照,28的收率为80%,该反应机理与苄基羧基化的机理类似。

图6. 环己烷的羧基化反应。图片来源:J. Am. Chem. Soc.
在相同的反应条件下,作者探究了其它环状和链状饱和烷烃的光催化羧化反应,如图7所示,环戊烷31也能够发生羧化反应生成环戊甲酸32,尽管收率低于环己烷;当正戊烷33作为底物时,得到三种羧酸异构体的混合物,其比例为1:8:3,这体现了不同烷基自由基中间体的稳定性。
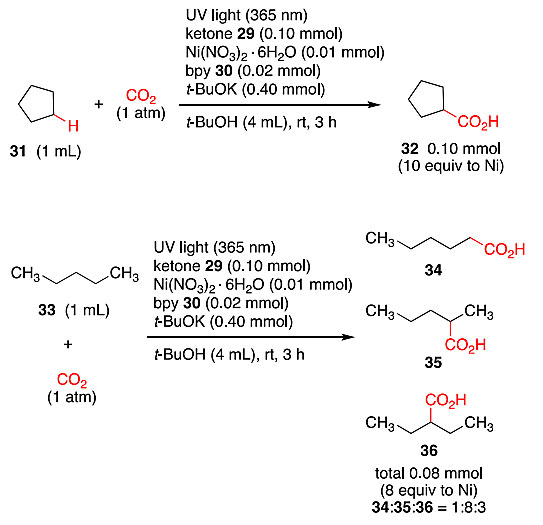
图7. 烷烃的羧基化反应。图片来源:J. Am. Chem. Soc.
总结
综上所述,Masahiro Murakami课题组发展了在光/酮/镍的协同诱导下,能够在常温常压下实现苄基C(sp3)-H键与CO2的羧基化反应,并且将该羧基化反应成功地扩展到饱和烷烃,例如环己烷、环戊烷以及正戊烷。该羧化反应为从简单易得的烃类化合物制备增加一个碳原子的羧酸提供了一种简便高效的方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Carboxylation of Benzylic and Aliphatic C−H Bonds with CO2 Induced by Light/Ketone/Nickel
Naoki Ishida, Yusuke Masuda, Yuuya Imamura, Katsushi Yamazaki, Masahiro Murakami
J. Am. Chem. Soc., 2019, DOI: 10.1021/jacs.9b12529
导师介绍
Masahiro Murakami
https://www.x-mol.com/university/faculty/49632
(本文由有所不为供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号