List组有机催化“里程碑”级Science:手性Brønsted酸催化的惰性烯烃不对称活化
作为继金属催化和酶催化之后的第三类不对称催化反应,有机分子参与的不对称催化在过去的十多年中得到了极大的发展。其中,手性Brønsted酸(HB)催化剂具有良好的结构修饰性、极好的底物兼容性和特殊的双功能活化作用机制,更是被广泛应用于这一新兴的不对称催化领域。目前已报道的HB催化的不对称反应类型包括Michael加成、Strecker反应、Mannich反应、Aldol反应、Friedel-Crafts反应、Aza-Diels-Alder反应、Nazarov反应、Pictet-Spengler反应、1,3-偶极环加成、多组分串联环化反应等。尽管如此,人们认为现有的手性HB催化剂还远远无法满足不对称化学发展的需求,主要原因在于绝大多数手性HB催化的不对称反应中,HB与底物的作用模式都局限于通过形成氢键或亚铵离子对活化羰基、亚胺和硝基,或通过质子化底物形成氮杂富烯离子对或烯丙基离子对活化羟基。因此,发展新型的手性HB活化模式实现更多类型底物参与的不对称反应仍然是该领域亟待解决的问题。
烯烃的分子内不对称氢官能团化反应是化学家合成手性氮杂和氧杂环化合物的重要方法。丰富多样的手性配体和手性阴离子试剂促使金属催化剂在数十年来占据这一领域的主导地位,与金属配位的烯烃碳碳双键接受分子内亲核官能团的进攻形成环化产物是这类反应普遍认可的机理。而在自然界中,烯烃不对称环化反应的主角则是生物酶,该类反应通过烯烃的质子化作用形成碳正离子,进而诱导多烯基化合物串联环化。基于此,化学家们在超分子化学和酶化学领域也开启了烯烃的仿生不对称环化反应的研究,但成功的报道屈指可数。相比之下,在有机分子不对称催化领域,人们曾一度认为手性HB很难像金属和酶催化剂一样通过直接活化烯烃的模式来促使这类反应的发生。由于这类有机分子催化剂酸性较弱,不易与弱亲电性、弱碱性的烯烃双键发生反应,即使可以通过质子化作用活化烯烃,也不能像酶那样通过空腔结构帮助活泼的碳正离子实现不对称反应。例如,Ackermann等人曾尝试使用手性磷酸在130 ℃的高温下催化烯烃发生分子内的不对称氢胺化反应,仅以19%的ee 值获得氮杂环产物(未报道产率)。

Benjamin List教授。图片来源:Max-Planck-Institut für Kohlenforschung
这一局面是否有可能得到真正的改变?答案是肯定的。近日,德国马克斯•普朗克煤炭研究所的Benjamin List教授等人报道了手性HB催化非活化烯烃的分子内氢官能团化的突破性进展。与经典的手性HB催化剂作用于底物中羰基、硝基、亚胺基、羟基等极性官能团的反应机制不同,他们精心设计的双轴手性磷酰亚胺催化剂可通过惰性烯烃分子碳碳双键的质子化作用启动反应,促使各种1,1-二取代的烯烃底物发生分子内氢烷氧基化反应,高对映选择性地得到一系列含季碳中心的α-四氢呋喃化合物。该方法还可用于(–)-Boivinianin A等生物活性分子的合成,相关工作发表在Science 杂志上。
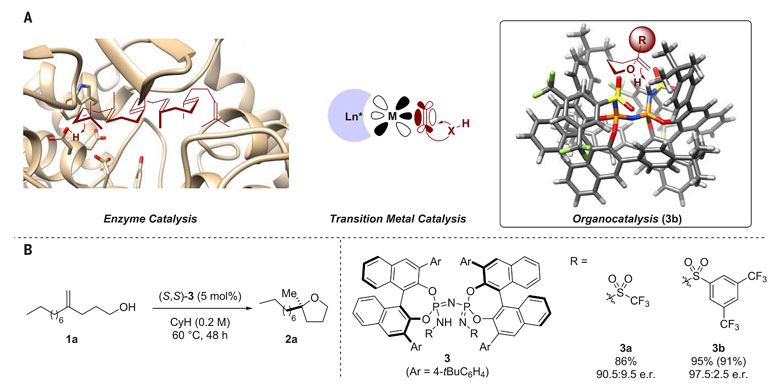
图1. 生物及化学途径的烯烃活化。图片来源:Science
此前,Benjamin List教授曾设计了具有双轴手性骨架的亚胺二磷酰亚胺类催化剂3a,他们发现3a除了可以作为Brønsted酸催化非活化共轭双烯与醛的不对称[4+2]环加成反应,还可作为Lewis碱前体催化烯丙基硅与醛的不对称加成反应以及硅基烯酮缩醛与α,β-不饱和酯的不对称Mukaiyama-Michael反应,反应皆具有优秀的立体选择性。他们认为催化剂的活性位点由磷酸改造为三氟甲磺酰胺大大提高了3a的酸性,可改善催化剂的反应活性,同时,两个BINOL骨架让这种空间受限的手性Brønsted酸(Confined chiral Brønsted acid)能够提供像酶一样带有活性中心的手性微环境,可进一步提高催化剂的立体控制能力。那么这种催化剂是否真的能像酶一样催化烯烃的不对称环化反应呢?作者首先选择了无立体位阻效应的电中性烯烃1a为底物,以环己烷为溶剂,在60 ℃下考察了5 mol%用量的(S,S)-3a催化烯烃分子内的不对称氢烷氧基化反应,能以81%的ee 值和86%的核磁产率得到α位甲基烷基取代的手性四氢呋喃产物2a。他们进一步将催化剂3a中N修饰的三氟甲磺酰基替换为位阻更大的3,5-双三氟甲基修饰的芳基磺酸((S,S)-3b),该反应能以95%的ee 值和91%的分离收率得到目标化合物2a(图1B)。
随后,作者以(S,S)-3b为催化剂对该反应的底物适用性进行了考察。电中性烯烃2中的R1取代基可以是多种链式脂肪基团,其末端可以兼容碳碳双键、醚、氨基和游离的羟基等官能团(2b-2f);当烯烃双键具有一定的立体位阻时,如R1为α位含有叔碳、季碳中心的烷基取代基时,反应具有中等到良好的产率和对映选择性(2g-2i)。共轭双烯底物2j、2k也能很好地适用于该反应。此外,富电子烯烃如多种取代基修饰的苯乙烯类底物(2l-2s)在反应中也具有不错的表现,当芳香环上存在吸电子取代基(2n, 2o)或羟基修饰的碳链上含有季碳中心(2s)时,反应往往需要较长的时间。延长底物中羟基修饰的碳链,反应也能以良好的结果生成光学活性的六元环产物α-四氢吡喃(2t,2u)(图2)。
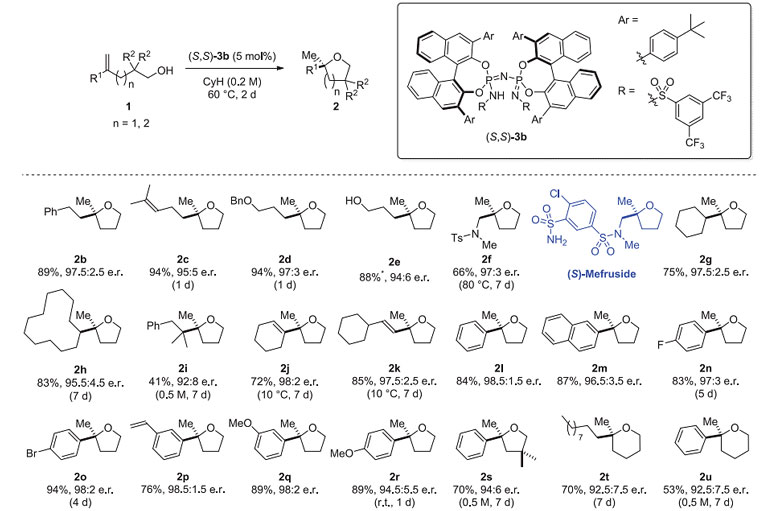
图2. 底物适用性的考察。图片来源:Science
以(R,R)和(S,S)构型的3b为催化剂,以含有一个手性中心的(S)-1v和(R)-1w为底物,反应能以优秀的非对映选择性生成具有两个手性碳的α-四氢呋喃化合物。从苯乙烯类底物1x出发,反应依次通过烯烃的不对称氢烷氧基化和氧化能够得到生物活性分子(-)-Boivinianin A。接着,作者对极具挑战性的分子间氢烷氧基化反应进行了初步探索,在(S,S)-3c的催化下,苯乙烯与苄醇反应能以53%的ee 值和95%的收率生成相应的产物(图3)。
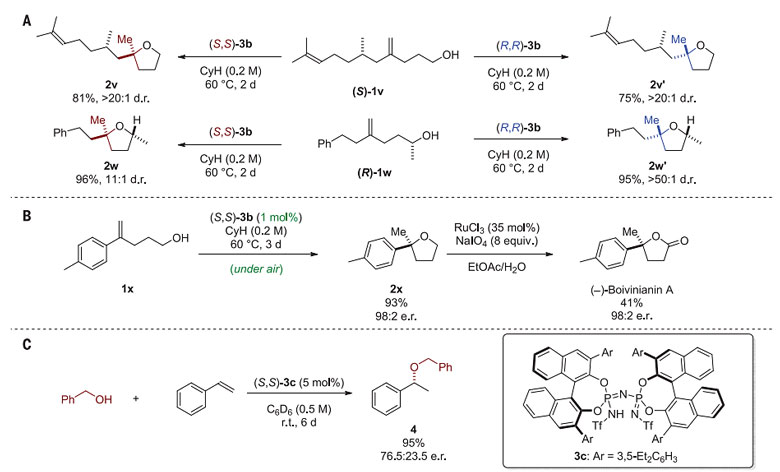
图3. 反应的进一步应用。图片来源:Science
DFT计算表明,该反应通过烯烃质子化-环化反应途径进行,并且C=C双键的质子化与C-O键的形成过程协同发生,生成两种异构体的过渡态(TS1和TS1')能垒相差1.6 kcal/mol。他们发现苯乙烯类底物芳香环上对位取代基的Hammett常数(σ+)与反应速率(logKx/KH)呈负线性关系,反应常数ρ为-2.08±0.04,这表明决速步中反应中心的正电荷密度升高,与DFT计算的反应过渡态一致。此外,当使用其他可通过质子化形成碳正离子的底物5-7时,反应不发生或仅以较低的产率及选择性生成相应的产物,进一步排除了先形成碳正离子、再环化分步的反应途径(图4)。
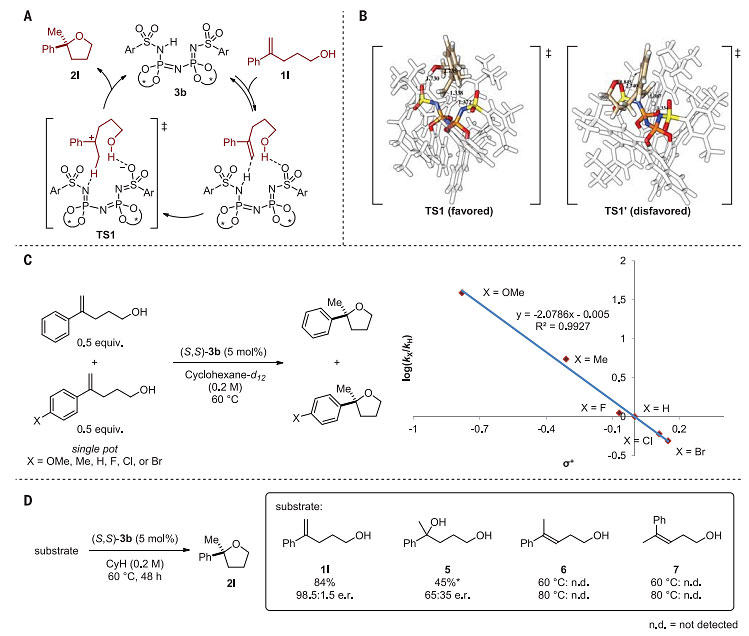
图4. DFT计算和实验验证的机理研究。图片来源:Science
——总结——
Benjamin List教授等人发展了一种手性Brønsted酸催化中性、无立体位阻效应的烯烃分子内的不对称氢烷氧基化反应,高效合成了一系列含有手性季碳的α-四氢呋喃衍生物。反应具有操作简单、产率高、官能团兼容性好、绿色环保等优点。双轴手性的BINOL骨架及芳基磺酰胺的引入让亚胺二磷酰亚胺类催化剂3b可高效实现惰性烯烃的直接活化和季碳中心手性的调控。机理研究表明,反应通过协同的烯烃质子化-亲核环化途径进行。毫无疑问,Benjamin List教授又一次为有机分子的不对称催化带来了崭新的活化概念和催化模式,这项具有里程碑意义的工作将激励化学家们开发丰富多样的人工质子化酶——手性Brønsted酸,实现更多烯烃乃至炔烃底物的氢官能团化反应。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Activation of olefins via asymmetric Brønsted acid catalysis
Science, 2018, 359, 1501, DOI: 10.1126/science.aaq0445
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!














































 京公网安备 11010802027423号
京公网安备 11010802027423号