当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural Basis of Small Molecule Targetability of Monomeric Tau Protein.
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2018-07-16 , DOI: 10.1021/acschemneuro.8b00182 Róbert Kiss 1 , Georgina Csizmadia 1 , Katalin Solti 1 , Attila Keresztes 1 , Max Zhu 2 , Marcus Pickhardt 3, 4 , Eckhard Mandelkow 3, 4 , Gergely Tóth 1, 2
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2018-07-16 , DOI: 10.1021/acschemneuro.8b00182 Róbert Kiss 1 , Georgina Csizmadia 1 , Katalin Solti 1 , Attila Keresztes 1 , Max Zhu 2 , Marcus Pickhardt 3, 4 , Eckhard Mandelkow 3, 4 , Gergely Tóth 1, 2
Affiliation
|
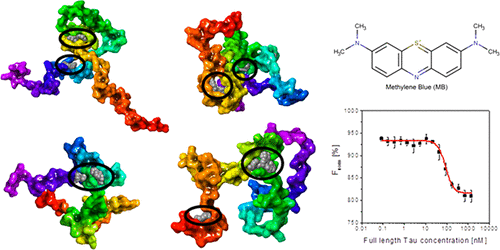
The therapeutic targeting of intrinsically disordered proteins (IDPs) by small molecules has been a challenge due to their heterogeneous conformational ensembles. A potential therapeutic strategy to alleviate the aggregation of IDPs is to maintain them in their native monomeric state by small molecule binding. This study investigates the structural basis of small molecule druggability of native monomeric Tau whose aggregation is linked to the onset of Tauopathies such as Alzheimer's disease. Initially, two available monomeric conformational ensembles of a shorter Tau construct K18 (also termed Tau4RD) were analyzed which revealed striking structural differences between the two ensembles, while similar number of hot spots and small molecule binding sites were identified on monomeric Tau ensembles as on tertiary folded proteins of similar size. Remarkably, some critical fibril forming sequence regions of Tau (V306-K311, V275-K280) participated in hot spot formation with higher frequency compared to other regions. As an example of small molecule binding to monomeric Tau, it was shown that methylene blue (MB) bound to monomeric K18 and full-length Tau selectively with high affinity (Kd = 125.8 nM and 86.6 nM, respectively) with binding modes involving Cys291 and Cys322, previously reported to be oxidized in the presence of MB. Overall, our results provide structure-based evidence that Tau can be a viable drug target for small molecules and indicate that specific small molecules may be able to bind to monomeric Tau and influence the way in which the protein interacts among itself and with other proteins.
中文翻译:

Tau蛋白单体的小分子靶向性的结构基础。
由于小分子的异质构象集合,小分子对内在无序蛋白(IDP)的治疗靶向一直是一个挑战。减轻IDP聚集的潜在治疗策略是通过小分子结合将其保持在其天然单体状态。这项研究调查了天然单体Tau的小分子可药物性的结构基础,该天然Tau的聚集与陶氏病(如阿尔茨海默氏病)的发作有关。最初,分析了两个较短的Tau构建体K18的可用单体构象集成体(也称为Tau4RD),发现这两个集成体之间存在显着的结构差异,而在单体Tau集成体上发现的热点和小分子结合位点数量与第三级相似。折叠大小相似的蛋白质。值得注意的是,与其他区域相比,Tau的一些关键原纤维形成序列区域(V306-K311,V275-K280)以更高的频率参与了热点形成。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。与其他地区相比,V275-K280)参与热点形成的频率更高。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。与其他地区相比,V275-K280)参与热点形成的频率更高。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。结果表明,亚甲基蓝(MB)以高亲和力(分别为Kd分别为125.8 nM和86.6 nM)与Cys291和Cys322的结合模式高选择性地结合到单体K18和全长Tau上,先前报道过在存在Cys291和Cys322的情况下会被氧化。 MB。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响蛋白质彼此之间以及与其他蛋白质相互作用的方式。结果表明,亚甲基蓝(MB)以高亲和力(分别为Kd分别为125.8 nM和86.6 nM)与Cys291和Cys322的结合模式高选择性地结合到单体K18和全长Tau上,先前报道过在存在Cys291和Cys322的情况下会被氧化。 MB。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。
更新日期:2018-06-26
中文翻译:

Tau蛋白单体的小分子靶向性的结构基础。
由于小分子的异质构象集合,小分子对内在无序蛋白(IDP)的治疗靶向一直是一个挑战。减轻IDP聚集的潜在治疗策略是通过小分子结合将其保持在其天然单体状态。这项研究调查了天然单体Tau的小分子可药物性的结构基础,该天然Tau的聚集与陶氏病(如阿尔茨海默氏病)的发作有关。最初,分析了两个较短的Tau构建体K18的可用单体构象集成体(也称为Tau4RD),发现这两个集成体之间存在显着的结构差异,而在单体Tau集成体上发现的热点和小分子结合位点数量与第三级相似。折叠大小相似的蛋白质。值得注意的是,与其他区域相比,Tau的一些关键原纤维形成序列区域(V306-K311,V275-K280)以更高的频率参与了热点形成。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。与其他地区相比,V275-K280)参与热点形成的频率更高。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。与其他地区相比,V275-K280)参与热点形成的频率更高。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。结果表明,亚甲基蓝(MB)以高亲和力(分别为Kd分别为125.8 nM和86.6 nM)与Cys291和Cys322的结合模式高选择性地结合到单体K18和全长Tau上,先前报道过在存在Cys291和Cys322的情况下会被氧化。 MB。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响蛋白质彼此之间以及与其他蛋白质相互作用的方式。结果表明,亚甲基蓝(MB)以高亲和力(分别为Kd分别为125.8 nM和86.6 nM)与Cys291和Cys322的结合模式高选择性地结合到单体K18和全长Tau上,先前报道过在存在Cys291和Cys322的情况下会被氧化。 MB。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。











































 京公网安备 11010802027423号
京公网安备 11010802027423号