当前位置:
X-MOL 学术
›
Atmos. Environ.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Iron dissolution and speciation in atmospheric mineral dust: Metal-metal synergistic and antagonistic effects
Atmospheric Environment ( IF 4.2 ) Pub Date : 2018-08-01 , DOI: 10.1016/j.atmosenv.2018.06.010 Eshani Hettiarachchi , Richard L. Reynolds , Harland L. Goldstein , Bruce Moskowitz , Gayan Rubasinghege
Atmospheric Environment ( IF 4.2 ) Pub Date : 2018-08-01 , DOI: 10.1016/j.atmosenv.2018.06.010 Eshani Hettiarachchi , Richard L. Reynolds , Harland L. Goldstein , Bruce Moskowitz , Gayan Rubasinghege
|
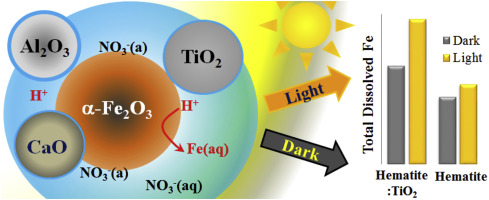
Abstract Under acidic atmospheric conditions, iron leached from atmospheric mineral dust may influence the distribution of bioavailable iron at a global scale. However, the effects of non-Fe-containing minerals on iron dissolution remain unknown. This work describes metal-metal synergistic and antagonistic effects on iron dissolution that go beyond aggregation and ionic strength effects in mineral dust mixtures. In this study, we investigated iron mobilization by proton-promoted dissolution in natural mineral dust samples from the Kalahari Desert (SZ1) and Australian Red Dawn event (RO), along with one iron oxide proxy, hematite. The total iron dissolution in natural dust samples highly corresponds with the respective amount of Ti, rather than their particle sizes or Fe contents. The dust sample with high Ti content, SZ1, also showed a higher fraction of dissolved Fe(II), under dark conditions. These observations are in good agreement with the dissolution data for hematite artificially mixed with metal oxides. Total iron dissolution in hematite, mixed with TiO2, is 1.5- and 2-fold higher compared to that of just hematite under dark and light conditions, respectively. However, dissolution of hematite is suppressed when mixed with Al2O3 and CaO. Under dark conditions, furthermore, dissolved Fe(II) fraction is enhanced for hematite when mixed with TiO2 compared to that of other mixtures or hematite alone. Yet, dissolved Fe(II) is lower in hematite mixed with TiO2 under light conditions compared to that of hematite alone, suggesting photo-oxidation of Fe(II) by reactive oxygen species, such as OH radicals.
中文翻译:

大气矿物粉尘中的铁溶解和物种形成:金属-金属协同和拮抗作用
摘要 在酸性大气条件下,从大气矿物粉尘中浸出的铁可能会影响全球范围内生物可利用铁的分布。然而,非含铁矿物对铁溶解的影响仍然未知。这项工作描述了金属-金属对铁溶解的协同和拮抗作用,这些作用超出了矿物粉尘混合物中的聚集和离子强度影响。在这项研究中,我们研究了来自喀拉哈里沙漠 (SZ1) 和澳大利亚赤色黎明事件 (RO) 的天然矿物尘埃样品中质子促进溶解的铁动员,以及一种氧化铁替代品赤铁矿。天然粉尘样品中的总铁溶解量与各自的 Ti 量高度对应,而不是它们的粒径或 Fe 含量。含钛量高的粉尘样品,SZ1,在黑暗条件下,还显示出更高比例的溶解 Fe(II)。这些观察结果与人工与金属氧化物混合的赤铁矿的溶解数据非常一致。在与 TiO2 混合的赤铁矿中,与仅在黑暗和光照条件下的赤铁矿相比,总铁溶解度分别高 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。这些观察结果与人工与金属氧化物混合的赤铁矿的溶解数据非常一致。在与 TiO2 混合的赤铁矿中的总铁溶解量分别是在黑暗和明亮条件下赤铁矿的 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。这些观察结果与人工与金属氧化物混合的赤铁矿的溶解数据非常一致。在与 TiO2 混合的赤铁矿中,与仅在黑暗和光照条件下的赤铁矿相比,总铁溶解度分别高 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与 TiO2 混合,在黑暗和光照条件下,分别是赤铁矿的 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与 TiO2 混合,在黑暗和光照条件下,分别是赤铁矿的 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。
更新日期:2018-08-01
中文翻译:

大气矿物粉尘中的铁溶解和物种形成:金属-金属协同和拮抗作用
摘要 在酸性大气条件下,从大气矿物粉尘中浸出的铁可能会影响全球范围内生物可利用铁的分布。然而,非含铁矿物对铁溶解的影响仍然未知。这项工作描述了金属-金属对铁溶解的协同和拮抗作用,这些作用超出了矿物粉尘混合物中的聚集和离子强度影响。在这项研究中,我们研究了来自喀拉哈里沙漠 (SZ1) 和澳大利亚赤色黎明事件 (RO) 的天然矿物尘埃样品中质子促进溶解的铁动员,以及一种氧化铁替代品赤铁矿。天然粉尘样品中的总铁溶解量与各自的 Ti 量高度对应,而不是它们的粒径或 Fe 含量。含钛量高的粉尘样品,SZ1,在黑暗条件下,还显示出更高比例的溶解 Fe(II)。这些观察结果与人工与金属氧化物混合的赤铁矿的溶解数据非常一致。在与 TiO2 混合的赤铁矿中,与仅在黑暗和光照条件下的赤铁矿相比,总铁溶解度分别高 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。这些观察结果与人工与金属氧化物混合的赤铁矿的溶解数据非常一致。在与 TiO2 混合的赤铁矿中的总铁溶解量分别是在黑暗和明亮条件下赤铁矿的 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。这些观察结果与人工与金属氧化物混合的赤铁矿的溶解数据非常一致。在与 TiO2 混合的赤铁矿中,与仅在黑暗和光照条件下的赤铁矿相比,总铁溶解度分别高 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与 TiO2 混合,在黑暗和光照条件下,分别是赤铁矿的 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与 TiO2 混合,在黑暗和光照条件下,分别是赤铁矿的 1.5 倍和 2 倍。然而,当与 Al2O3 和 CaO 混合时,赤铁矿的溶解受到抑制。此外,在黑暗条件下,与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。与其他混合物或单独的赤铁矿相比,当与 TiO2 混合时,赤铁矿的溶解 Fe(II) 分数增加。然而,与单独的赤铁矿相比,在光照条件下,与 TiO2 混合的赤铁矿中溶解的 Fe(II) 较低,这表明 Fe(II) 被活性氧物质(如 OH 自由基)光氧化。











































 京公网安备 11010802027423号
京公网安备 11010802027423号