Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural basis of ubiquitin modification by the Legionella effector SdeA
Nature ( IF 50.5 ) Pub Date : 2018-05-01 , DOI: 10.1038/s41586-018-0146-7 Yanan Dong , Yajuan Mu , Yongchao Xie , Yupeng Zhang , Youyou Han , Yu Zhou , Wenhe Wang , Zihe Liu , Mei Wu , Hao Wang , Man Pan , Ning Xu , Cong-Qiao Xu , Maojun Yang , Shilong Fan , Haiteng Deng , Tianwei Tan , Xiaoyun Liu , Lei Liu , Jun Li , Jiawei Wang , Xianyang Fang , Yue Feng
Nature ( IF 50.5 ) Pub Date : 2018-05-01 , DOI: 10.1038/s41586-018-0146-7 Yanan Dong , Yajuan Mu , Yongchao Xie , Yupeng Zhang , Youyou Han , Yu Zhou , Wenhe Wang , Zihe Liu , Mei Wu , Hao Wang , Man Pan , Ning Xu , Cong-Qiao Xu , Maojun Yang , Shilong Fan , Haiteng Deng , Tianwei Tan , Xiaoyun Liu , Lei Liu , Jun Li , Jiawei Wang , Xianyang Fang , Yue Feng
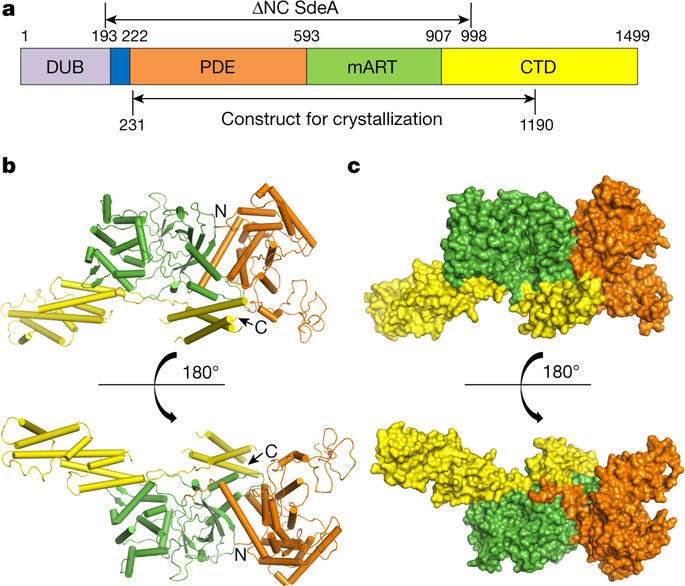
|
Protein ubiquitination is a multifaceted post-translational modification that controls almost every process in eukaryotic cells. Recently, the Legionella effector SdeA was reported to mediate a unique phosphoribosyl-linked ubiquitination through successive modifications of the Arg42 of ubiquitin (Ub) by its mono-ADP-ribosyltransferase (mART) and phosphodiesterase (PDE) domains. However, the mechanisms of SdeA-mediated Ub modification and phosphoribosyl-linked ubiquitination remain unknown. Here we report the structures of SdeA in its ligand-free, Ub-bound and Ub–NADH-bound states. The structures reveal that the mART and PDE domains of SdeA form a catalytic domain over its C-terminal region. Upon Ub binding, the canonical ADP-ribosyltransferase toxin turn-turn (ARTT) and phosphate-nicotinamide (PN) loops in the mART domain of SdeA undergo marked conformational changes. The Ub Arg72 might act as a ‘probe’ that interacts with the mART domain first, and then movements may occur in the side chains of Arg72 and Arg42 during the ADP-ribosylation of Ub. Our study reveals the mechanism of SdeA-mediated Ub modification and provides a framework for further investigations into the phosphoribosyl-linked ubiquitination process.Crystal structures of the Legionella effector SdeA in a ligand-free state and in complex with ubiquitin and NADH provide insight into SdeA-mediated phosphoribosyl-linked ubiquitination.
中文翻译:

军团菌效应物 SdeA 对泛素修饰的结构基础
蛋白质泛素化是一种多方面的翻译后修饰,几乎控制着真核细胞的每一个过程。最近,据报道军团菌效应物 SdeA 通过其单 ADP 核糖基转移酶 (mART) 和磷酸二酯酶 (PDE) 域对泛素 (Ub) 的 Arg42 进行连续修饰,从而介导独特的磷酸核糖基连接的泛素化。然而,SdeA 介导的 Ub 修饰和磷酸核糖基连接泛素化的机制仍然未知。在这里,我们报告了无配体、Ub 结合和 Ub-NADH 结合状态的 SdeA 结构。这些结构表明 SdeA 的 mART 和 PDE 结构域在其 C 端区域形成催化结构域。在 Ub 绑定后,SdeA 的 mART 结构域中的典型 ADP-核糖基转移酶毒素转向 (ARTT) 和磷酸-烟酰胺 (PN) 环发生显着的构象变化。Ub Arg72 可能充当“探针”,首先与 mART 结构域相互作用,然后在 Ub 的 ADP 核糖基化过程中,Arg72 和 Arg42 的侧链中可能发生运动。我们的研究揭示了 SdeA 介导的 Ub 修饰的机制,并为进一步研究磷酸核糖基连接的泛素化过程提供了框架。军团菌效应物 SdeA 在无配体状态下与泛素和 NADH 复合的晶体结构提供了对 SdeA 的深入了解介导的磷酸核糖连接泛素化。然后在 Ub 的 ADP-核糖基化过程中,Arg72 和 Arg42 的侧链可能发生运动。我们的研究揭示了 SdeA 介导的 Ub 修饰的机制,并为进一步研究磷酸核糖基连接的泛素化过程提供了框架。军团菌效应物 SdeA 在无配体状态下与泛素和 NADH 复合的晶体结构提供了对 SdeA 的深入了解介导的磷酸核糖连接泛素化。然后在 Ub 的 ADP-核糖基化过程中,Arg72 和 Arg42 的侧链可能发生运动。我们的研究揭示了 SdeA 介导的 Ub 修饰的机制,并为进一步研究磷酸核糖基连接的泛素化过程提供了框架。军团菌效应物 SdeA 在无配体状态下与泛素和 NADH 复合的晶体结构提供了对 SdeA 的深入了解介导的磷酸核糖连接泛素化。
更新日期:2018-05-01
中文翻译:

军团菌效应物 SdeA 对泛素修饰的结构基础
蛋白质泛素化是一种多方面的翻译后修饰,几乎控制着真核细胞的每一个过程。最近,据报道军团菌效应物 SdeA 通过其单 ADP 核糖基转移酶 (mART) 和磷酸二酯酶 (PDE) 域对泛素 (Ub) 的 Arg42 进行连续修饰,从而介导独特的磷酸核糖基连接的泛素化。然而,SdeA 介导的 Ub 修饰和磷酸核糖基连接泛素化的机制仍然未知。在这里,我们报告了无配体、Ub 结合和 Ub-NADH 结合状态的 SdeA 结构。这些结构表明 SdeA 的 mART 和 PDE 结构域在其 C 端区域形成催化结构域。在 Ub 绑定后,SdeA 的 mART 结构域中的典型 ADP-核糖基转移酶毒素转向 (ARTT) 和磷酸-烟酰胺 (PN) 环发生显着的构象变化。Ub Arg72 可能充当“探针”,首先与 mART 结构域相互作用,然后在 Ub 的 ADP 核糖基化过程中,Arg72 和 Arg42 的侧链中可能发生运动。我们的研究揭示了 SdeA 介导的 Ub 修饰的机制,并为进一步研究磷酸核糖基连接的泛素化过程提供了框架。军团菌效应物 SdeA 在无配体状态下与泛素和 NADH 复合的晶体结构提供了对 SdeA 的深入了解介导的磷酸核糖连接泛素化。然后在 Ub 的 ADP-核糖基化过程中,Arg72 和 Arg42 的侧链可能发生运动。我们的研究揭示了 SdeA 介导的 Ub 修饰的机制,并为进一步研究磷酸核糖基连接的泛素化过程提供了框架。军团菌效应物 SdeA 在无配体状态下与泛素和 NADH 复合的晶体结构提供了对 SdeA 的深入了解介导的磷酸核糖连接泛素化。然后在 Ub 的 ADP-核糖基化过程中,Arg72 和 Arg42 的侧链可能发生运动。我们的研究揭示了 SdeA 介导的 Ub 修饰的机制,并为进一步研究磷酸核糖基连接的泛素化过程提供了框架。军团菌效应物 SdeA 在无配体状态下与泛素和 NADH 复合的晶体结构提供了对 SdeA 的深入了解介导的磷酸核糖连接泛素化。











































 京公网安备 11010802027423号
京公网安备 11010802027423号